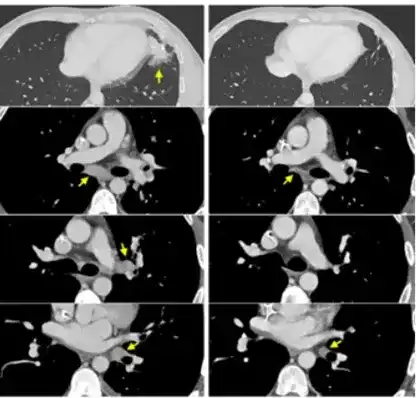
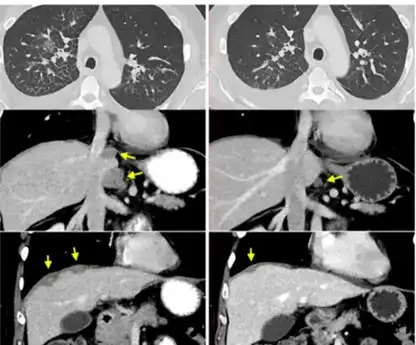
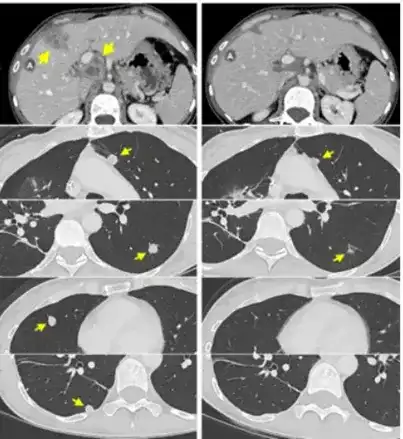
在最近几年里,癌症治疗技术有了显著进步,特别是细胞免疫治疗的兴起,为众多癌症患者带来了新的生机。TCR-T疗法是继LAK和TIL免疫治疗之后,为癌症患者提供了一种更为精确的细胞免疫治疗选择。这种疗法因其在特定癌症治疗上的显著成效和高昂的治疗成本而成为焦点。 然而,520万一针的TCR-T疗法真的值得吗? 该疗法研发复杂,涉及人力、物力和财力的大量投入,技术与设备要求高,资金需求巨大。 TCR-T疗法治疗效果显著,尤其在多种实体瘤治疗中,为传统治疗无效患者提供希望。 尽管如此,TCR-T疗法存在风险,如细胞因子释放综合征和脱靶效应,需密切监测。适应症亦需扩展,以帮助更多患者。 那么,TCR-T疗法真的能成为肝癌、肠癌、胰腺癌、肉瘤等多种实体瘤患者的“救星”吗? 2024年5月29日,《临床和分子肝病学》期刊上刊登了来自北京协和医院研究团队的文章,题目为“利用基因改造的重定向T细胞针对临床环境中HBsAg阳性肝细胞和肝细胞癌病变”。这项研究通过在一位患有与HBV相关的肝细胞癌患者身上进行临床试验,证实了SCG101 T细胞疗法的安全性和有效性。 研究显示:SCG101 T疗法能精确靶向HBV感染和肝癌细胞,显著降低血清HBsAg水平,并持续控制肿瘤。 截图来源于[1] 研究团队对一名54岁、无法手术的HBV-HCC患者进行了单剂SCG101输注,并随访6.9个月。患者携带HLA-A*02:01基因,肝功能为Child-Pugh A级,且身体状况良好。患者曾接受多种治疗。治疗后,进行了淋巴细胞清除化疗和SCG101回输。 治疗结果显示肿瘤灶显著缩小,基线时右叶多个结节和两个靶病灶,SCG101输注后第28天观察到大面积肿瘤坏死,靶肿瘤病灶减少74.5%和47.5%。病情维持稳定状态至少6.9个月,HBV特异性T细胞展现出抗病毒和抗肿瘤的活性。患者部分缓解,目标病变缩小70%以上。 血清HBsAg水平显著降低,从557.96IU/ml降至1.3IU/ml,降幅超过3.84log10~0.08IU/mL,持续6个月以上。治疗73天后,肝活检未发现表达HBsAg的肝细胞。 治疗过程中患者出现了短暂的肝功能受损等不良反应,但均为可逆,患者耐受性良好。SCG101毒性低于传统疗法,为临床推广奠定基础。 2024年7月11日,来自美国癌症研究协会的研究小组在《自然医学》杂志上发表了一篇研究性文章。该研究涉及7名结肠直肠癌患者,他们均具有正常的MMR(错配修复)功能,并且在经历两种或以上的化疗后病情仍然恶化,属于晚期患者。研究中,患者在部分手术后,通过肿瘤样本识别出新抗原和相应的反应性T细胞。这些新抗原反应性TCR被编码进逆转录病毒载体,并转移到患者的自体外周血淋巴细胞中,目的是提升他们对肿瘤的免疫反应能力。 截图来源于[2] 研究表明:7名接受TCR-T细胞疗法转移性结直肠癌患者中,有3名患者的肝、肺和淋巴结转移病灶出现了缩小,这种客观反应持续了4到7个月。他们的中位无进展生存期为4.6个月。总体上,这种疗法的耐受性是令人满意的。 病例一:直肠癌转移,左肺切除后出现局部复发以及纵隔淋巴结缩小。 图为患者一之后的CT扫描结果 病例二:患有转移性结肠癌的病人,其支气管镜检查显示右肺淋巴管炎(位于顶部,沿轴向)以及腹膜后淋巴结和肝脏周围肿瘤(位于中下部,沿冠状方向)有所缩小。 图为患者二之后的CT扫描结果 病例三:患有转移性直肠癌的病人,其肝脏转移、门静脉淋巴结以及多个肺部转移情况有所减轻。 为患者三之后的CT扫描结果 研究初步显示,基因改造 T 细胞治疗转移性结直肠癌是可耐受的,并能引起肿瘤消退。试验在美国进行中,期待后续公布更多临床结果。 美国日本专家线上远程咨询/赴日赴美就医 海外专家第二诊疗意见定制个人方案 ▼ 2022年6月2日,在《新英格兰医学杂志》上刊登了一篇由美国波特兰普罗维登斯癌症中心研究团队撰写的名为《Neoantigen T-Cell Receptor Gene Therapy in Pancreatic Cancer》的研究文章。文章介绍了创新的T细胞免疫疗法,专门针对携带KRAS G12D突变的胰腺癌患者。 文章指出,一名携带KRAS G12D基因突变的晚期转移性胰腺癌患接受了162亿个免疫细胞一次性注射后,一个月内肿瘤转移灶开始缩小。六个月后,肿瘤体积减少了72%,表明该疗法有效控制了病情进展。 截图来源于[3] 这位受益者是一位72岁的女性患者,她是全球首位因接受这种疗法而获益的晚期胰腺癌患者。 2018年,患者确诊胰腺癌,并接受四轮FOLFIRINOX治疗后,随后进行了保留幽门的Whipple手术,切除了边缘阴性低分化腺癌,肿瘤伴有两处淋巴结转移,最大直径4.5厘米。 在完成治疗后,患者的癌症被重新评估为IIB期。她随后接受了四次FOLFIRINOX辅助化疗,并接受了50.4Gy的放疗,同时配合使用卡培他滨。 在治疗过程中,患者病情曾一度得到缓解,未发现肿瘤扩散。但是到了2019年,癌症不幸复发。通过肺部右下叶的细针穿刺,医生确认了肺部转移的情况。 2020年,患者参与了匹兹堡大学医学中心的一项临床试验,该试验旨在探索一种名为TILs的新型免疫细胞疗法。然而,令人遗憾的是,经过六个月的观察,研究人员发现患者体内的肺转移瘤仍在持续增大,这表明TILs治疗并未达到预期的效果。感到无望之际,患者获知美国食品药品监督管理局(FDA)于2021年5月对一种新的免疫疗法——TCR-T研究性新药申请给予了批准,该疗法专门针对特定患者群体。她决定抓住这最后的希望,决定参与这项实验。 2021年6月,患者加入TCR-T临床试验,并从她体内提取T细胞,进行基因编辑,生成了能识别并攻击KRAS G12D突变癌细胞的TCR-T细胞。随后,这些经过特殊处理的T细胞被重新注入该患者体内。 令人欣慰的是,治疗仅进行了一个月,患者体内的肿瘤转移灶就开始出现缩小迹象。经过六个月的持续治疗,专业评估结果显示,患者的肿瘤已经缩小了72%。 2024年8月2日,全球首个针对实体肿瘤的Afami-cel获得批准。数据显示,总体反应率为43%,4.5%患者癌症完全消失,患者两年生存率为70%,为难治性肉瘤患者带来希望,也是滑膜肉瘤10多年来首个新治疗方案。 截图来源于[6] Afami-cel获准用于特定HLA类型晚期MAGE-A4+滑膜肉瘤成人患者治疗,成为首款TCR-T疗法,具有里程碑意义。这也是十多年来首个有效治疗滑膜肉瘤的疗法。 在这项研究中,所有患者都患有晚期且已经转移的疾病,并且之前已经接受了三种不同类型的系统性治疗。在使用Afami-cel治疗的52名患者中,有36.5%的患者实现了客观缓解,而疾病控制率达到了88.4%。对于滑膜肉瘤患者,缓解的平均持续时间大约为12个月。根据生存分析,在平均随访27.8个月后,平均持续反应时间是11.6个月。 对于晚期滑膜肉瘤患者来说,以往的二线治疗效果不佳,客观缓解率低,患者的总生存期通常不足12个月。然而,这项试验成功达到了其主要的疗效目标,并在CTOS年会上进行了公布。在大量已经接受过多次治疗的患者中,Afami-cel治疗的客观缓解率为39%,中位生存期约为17个月,这比以往的数据要好。70%接受Afami-cel治疗的患者在两年后仍然存活,这对于那些难以治疗的肉瘤患者来说是一个重大的生存进展。 TCR-T疗法之所以能够在实体瘤治疗中取得显著效果,主要得益于其独特的优势: 1、广泛适应症:TCR-T疗法能识别多种肿瘤特异性蛋白,例如CEA、CD19、Her-2等,适用于多种实体瘤治疗。 2、无靶细胞表面抗原限制:TCR-T疗法能识别肿瘤细胞表面及内部抗原,不受靶细胞表面抗原表达限制,广泛识别靶抗原。 3、个性化治疗方案:TCR-T疗法通过改造患者T细胞,使其表达能有效识别肿瘤细胞的TCR,靶向特定癌症抗原,为患者提供更大缓解希望。 综上所述,TCR-T疗法在治疗肝癌、肠癌、胰腺癌、肉瘤等实体瘤方面展现出一定的潜力,但其疗效和前景仍需更多研究。高昂费用要求我们在政策、保险和资源分配上进行综合考虑,以让更多患者受益。尽管挑战重重,TCR-T疗法为实体瘤患者带来新希望,未来可能成为更多癌症患者的救星。 参考文献: [1]Genetically-modified,redirected T cells target hepatitis B surface antigen-positive hepatocytes and hepatocellular carcinoma lesions in a clinical setting. Clin Mol Hepatol. 2024. https://www.e-cmh.org/journal/view.php?doi=10.3350/cmh.2024.0058 [2]Adoptive transfer of personalized neoantigen-reactive TCR-transduced T cells in metastatic colorectal cancer: phase 2 trial interim results https://www.nature.com/articles/s41591-024-03109-0 [3]Neoantigen T-Cell Receptor Gene Therapy in Pancreatic Cancer https://www.nejm.org/doi/full/10.1056/NEJMoa2119662 [4]T-Cell Immunotherapy against Mutant KRAS for Pancreatic Cancer https://www.nejm.org/doi/full/10.1056/NEJMe2204283?query=recirc_curatedRelated_article [5]Targeting Cytotoxic T Cells to Tumor https://www.nejm.org/doi/full/10.1056/NEJMe2204286?query=recirc_curatedRelated_article [6]Adaptimmune Receives U.S.FDA Accelerated Approval of TECELRA®(afamitresgene autoleucel),the First Approved Engineered Cell Therapy for a Solid Tumor:Adaptimmune (ADAP) https://www.adaptimmune.com/investors-and-media/news-center/press-releases/detail/271/adaptimmune-receives-u-s-fda-accelerated-approval-of [7]https://www.adaptimmune.com/