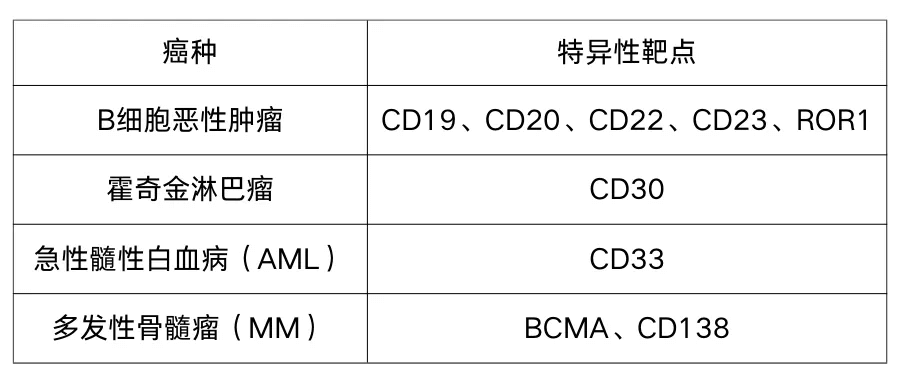
急性髓系白血病(AML)是一种血液系统恶性肿瘤,特点在于骨髓及外周血中未成熟髓细胞的异常增生。其显著表现为原始及早期幼稚细胞的大量增加,病情进展迅猛,自然病程短暂。此病临床表现多样,一方面,骨髓衰竭引发贫血、感染及出血;另一方面,白血病细胞浸润不同组织器官,导致肝脾肿大等症状。 2024年2月,《国家癌症中心》杂志发布的数据显示:2022年我国癌症新发病例482余万,男性与女性分别为253万和229万。其中,白血病新发病例为8.19万例,患者5年生存率仅为25.4%。同年1月,美国癌症协会发布报告指出:2024年美国癌症新发病例预计为200余万,男女分别约103万和97万。白血病新发病例6.28万例,患者5年生存率高达61.9%;其中,AML约20800例,患者5年生存率为27.1%。其他不同亚型的生存率也存在差异。 目前,AML的诊断主要依赖骨髓涂片中原始细胞的比例计数。近年来,随着流式细胞术、细胞遗传学以及分子遗传学在细胞分析领域的突飞猛进,对AML的生物学特性有了更深刻的认识。如今,以细胞形态学、免疫学、细胞遗传学和分子生物学为基础的综合诊断方法已成为主流,利用细胞遗传学和分子生物学技术对患者进行预后分层和个性化治疗显得尤为重要。 AML的治疗手段主要包括化疗、分子靶向治疗和造血干细胞移植等。然而,AML的复发往往导致预后不佳,尤其是针对复发/难治的AML患者,目前尚无统一、高效的治疗方案。传统的化疗临床缓解率有限。因此,探索新型治疗方法,对于改善复发/难治AML患者的预后至关重要。 CAR-T疗法借助精心设计的嵌合抗原受体(CAR),能精准锁定并连接至肿瘤细胞表面的特异性抗原。这一过程无需依赖MHC,即可有效地激活T细胞,展现出显著的抗肿瘤效果。 图源:摄图网 Emily是全球首例接受CAR-T疗法的小女孩。经历16个月化疗后,她的病情复发了。2012年4月,她勇敢地尝试CAR-T治疗。当时,治疗中心主任Carl June博士对此充满疑虑。然而,奇迹很快发生了!如今,五年过去,Emily体内癌细胞已无踪影。她的康复成为CTL019疗法的直接证据。据美国食品药品监督管理局(FDA)官网报道,涉及63名患者的临床试验显示,CTL019治疗后三个月内缓解率高达83%,证明了其安全性和有效性。 CAR-T疗法治疗关键在于识别癌细胞特异性抗原。CAR-T之所以首先在血液恶性肿瘤中取得应用突破,原因在于血液恶性肿瘤细胞拥有独特的靶点。这些靶点特异性极高,主要表达在血液恶性肿瘤细胞上,而在正常细胞中几乎不表达或表达量极低。其中CD19和BCMA靶点尤为突出,具备极高的特异性。目前,获得批准的CAR-T疗法均基于这两个靶点,引导CAR-T细胞精确地找到并攻击癌细胞。 常见的恶性血液肿瘤和对应的治疗靶点 图源:参考文献[9] 2024年,Cell Reports Medicine期刊上发表的一篇研究性文指出,CD37作为一种新型安全且高效的CAR-T疗法靶点,在AML治疗中展现出了巨大的潜力。 AML的治疗手段不断演进,但复发/难治性AML患者的预后依然严峻。CAR-T疗法作为治疗这类患者的重要手段,关键在于找到能够特异性识别并杀伤AML细胞,同时又不损伤正常细胞靶点。CD33和CD123作为目前临床试验的主要靶点,虽然取得了一定疗效,但依然存在瘤外毒性的问题。因此,寻找更安全、更具针对性的CAR-T疗法靶点成为了研究的重点。 CD37作为一种细胞表面糖蛋白,其独特的生物学分布特点使其成为了潜在的AML治疗靶点。与广泛分布于多种细胞类型中的其他四跨膜蛋白不同,CD37的表达主要局限于B细胞,而在其他造血细胞中的表达水平相对较低。这一特点使得CD37-CAR-T细胞在识别并杀伤AML细胞时,能够降低对正常细胞的毒性,从而避免了对健康髓系细胞和干细胞的损害。 该项研究中,研究人员对AML中CD37的表达情况进行了深入探究。结果表明:大多数AML患者中均存在CD37表达,包括白血病干细胞。基于这一发现,研究人员成功研发了针对CD37的CAR-T细胞疗法,并在AML治疗中取得了显著成果。 结果显示:CD37-CAR-T细胞在体外和体内实验中均展现出了强大的抗AML活性。在AML人源异种移植小鼠模型中,CD37-CAR-T细胞能够特异性地识别并杀伤AML细胞,同时分泌促炎细胞因子抑制癌症进展,且对正常细胞的毒性更低,从而有效避免了对健康髓系细胞和干细胞的损伤。 此外,研究还发现CD37的表达水平与AML的不良预后和较低生存率密切相关。这意味着通过针对CD37的CAR-T细胞疗法,我们有望为复发/难治性AML患者提供新的治疗策略,从而改善他们的预后和生存率。 在2021年美国临床肿瘤学会(ASCO)年会上,一项引人注目的多中心、中期临床研究结果公布,该研究针对CLL1靶点CAR-T治疗儿童复发/难治性急性髓系白血病(AML)。 该研究共招募了11名患有复发/难治性AML的儿童。在接受环磷酰胺/氟达拉滨清髓后,这些患儿接受了不同剂量的Anti-CLL1 CAR-T细胞治疗。研究发现,Anti-CLL1 CAR-T细胞在患儿体内8天即达中位扩增峰值,高效且迅速! 研究数据显示:患者总缓解率高达81.8%,疾病控制率更是高达90.9%。其中,10名患儿完全响应了治疗,一个月内CLL1+AML癌细胞被清除;5例达到极佳完的全缓解状态,微小残留病灶阴性;3例取得完全缓解,但微小残留病灶阳性;另有1例和1例分别达到部分缓解和疾病稳定状态。 在安全性方面,虽然患者在CAR-T细胞输注前后出现了3-4级血液学不良事件和1-3级细胞因子释放综合征,但并未观察到Anti-CLL1 CAR-T剂量限制性毒性或致命事件。 总体而言,这项研究展示了Anti-CLL1 CAR-T疗法在治疗儿童复发/难治性AML方面的巨大潜力,其快速、高效、精准且相对彻底的治疗效果为这类患儿带来了新的希望。 图源:https://www.mskcc.org/locations 纪念斯隆凯特琳癌症中心(MSK斯隆),是全球历史最悠久、规模最大的私立癌症治疗机构。130年来,该中心始终坚守以患者为核心的原则,不断突破创新,致力于提供全方位的癌症治疗,为每位患者及其家庭带来希望与力量。 作为国际知名的癌症研究中心,一直致力于寻找癌症治疗的新方法和途径。MSK斯隆的研究团队在CAR-T细胞疗法的基础上进行了创新,开发出了一种针对AML的新型CAR-T细胞疗法。该疗法通过精准识别AML细胞表面的特异性抗原,引导改造后的T细胞直接攻击并杀死癌细胞,从而实现对AML的有效治疗。 CAR-T技术如今已迈入成熟阶段,但在应用于人体之前,尚需获取关键的原材料——T细胞。目前,CAR-T细胞制备所依赖的T细胞主要来源于患者自身。这一选择能有效避免免疫排斥反应,为治疗过程奠定坚实基础。 作为一种前沿的抗癌治疗方式,CAR-T细胞疗法已对血液恶性肿瘤的治疗方式产生了深远影响。展望未来,它将继续在血液肿瘤治疗领域发挥重要作用,并有望拓展至实体肿瘤的治疗。目前,多项实体瘤临床试验已进入关键阶段,我们期待CAR-T细胞疗法未来能为我们带来更多惊喜与突破。 总之,CAR-T细胞疗法为AML患者提供了新的治疗选择,也为其他类型的癌症治疗提供了新的思路和方法。随着研究的不断深入和技术的不断完善,相信这种新型疗法将在未来发挥更大的作用,为更多的癌症患者带来福音。 参考文献: [1]Bingfeng Han, Rongshou Zheng, Hongmei Zeng, Shaoming Wang,Kexin Sun,Ru Chen, Li Li, Wenqiang Wei, Jie He, Cancer incidence and mortality in China, 2022,Journal of the National Cancer Center (2024). [2]Rebecca L. Siegel MPH,Angela N. Giaquinto MSPH,Ahmedin Jemal DVM, Cancer statistics, 2024,CA Cancer J Clin. 2024. [3]《美国国立综合癌症网络(NCCN)肿瘤学临床实践指南:急性髓系白血病》. 更新到了2023.V3(中文版) [4]The efficacy and safety of anti-CLL1 based CAR-T cells in children withrelapsed or refractory acute myeloid leukemia: A multicenter interim analysis.The American Society of Clinical Oncology Annual Meeting, 2021 [5]The efficacy and safetyof anti-CLL1 based CAR-T cells in children with relapsed or refractory acutemyeloid leukemia: A multicenter interim analysis.2021 ASCO Annual Meeting,Abstract #10000. [6]WillierS, et al. CLEC12A and CD33 coexpression as a preferential target for pediatricAML combinatorial immunotherapy. Blood. 2021. [7]CD37 is a safe chimeric antigen receptor target to treat acute myeloid leukemia https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00264-7 [8]Lu, J.Jiang, G. The journey of CAR-T therapy in hematological malignancies. Mol Cancer 21, 194 (2022). [9]https://mp.weixin.qq.com/s?__biz=MzU4NjUyNzYyOQ==&mid=2247528631&idx=1&sn=e56d3c09e21621f9e0f4043d7ee7e767&chksm=fdfbd655ca8c5f434fe5159b8ffe30e1f09d19aaa9a38f0c5c1cb7250991b16dfe9525e630cb&scene=27