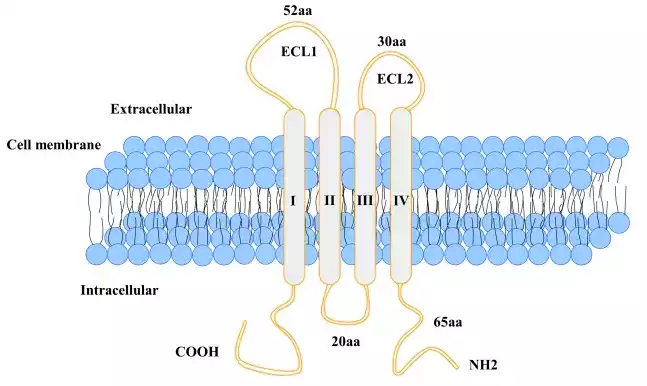
胃癌作为全球范围内最为常见的恶性肿瘤,其发病率与病死率分别位列全球所有恶性肿瘤的第5和第4位。虽然,胃癌根治术仍是胃癌唯一的治愈性治疗手段,以及早期发现、扩大淋巴结切除术的改进和辅助化疗都大大提高了胃癌的存活率。 然而,尽管这些治疗手段取得了显著进展,但90%以上的胃癌患者在术后5年内仍会出现复发;且胃癌复发也是导致患者死亡的主要原因。胃癌出现复发,说明癌症已经是晚期阶段了,患者生存期往往会减少。同时,胃癌复发也成为了限制胃癌疗效进一步提高的根本原因。因此,及时审视胃癌的复发因素与模式、治疗方法和预防策略至关重要。 尽管肿瘤已被移除 胃癌为何还会再次出现? 58岁的张先生是一位勇敢的抗癌斗士。五年前,他开始经历腹痛和体重减轻,经过医院的诊断,不幸被确诊为胃癌。在医生的建议下,张先生接受了根治性胃切除手术。经过五年来的多次复查,他的病情一直保持良好。 随着时间的推移,张先生和家人逐渐放松了警惕。由于复查过程繁琐,加上认为胃已经切除,张先生开始忽视医生关于长期随诊的建议。 然而,放松警惕带来了严重后果。近两个月,张先生频繁感到上腹疼痛、恶心和呕吐,体重也明显下降。这些症状让他回想起五年前的经历,不安的他带着家属去医院检查,结果却令人震惊。内镜检查显示:张先生的残胃黏膜出现了粗糙、糜烂、出血、隆起和溃疡,这是胃癌复发的迹象。 面对这一结果,张先生和家人感到非常困惑和焦虑:“这是复发了吗?”“接下来我们应该怎么办?还有治疗的可能吗?” 揭秘胃癌复发的关键因素 与复发模式 胃癌的成因是导致胃癌复发的关键因素;胃癌的组织学类型和肿瘤的生物学特性决定了胃癌复发的风险;内镜微创治疗的标准化和技能水平也是影响胃癌复发的重要因素;而胃癌的复发形式主要为原位复发、残胃复发、区域复发以及远处转移等。 此外,胃癌细胞利用多种机制逃避机体免疫系统的监控,也导致其在手术后存活并可能复发。中山大学的研究团队于2024年1月在《Cancer Letters》期刊上发表了题为“IKZF4/NONO-RAB11FIP3轴促进胃癌免疫逃逸通过促进PD-L1内体循环”的研究论文。该研究不仅阐明了胃癌发展和肿瘤免疫逃逸的分子机制,还为胃癌患者提供了可能的治疗靶点。 图源:参考文献【2】 因此,临床上需要仔细分析胃癌的组织学类型、生物学特性、临床病理特征等,深入理解其术后复发的高风险因素、潜在机制和临床表现,以选择恰当的治疗方案。 胃癌复发或单一 转移因素的治疗措施 对于复发或仅有单一转移的胃癌患者,治疗方案需根据转移的具体位置进行个性化定制。随着药物治疗有效性的提升,这类患者有了接受局部治疗甚至完全治愈的可能性。 尽管目前缺乏大规模的前瞻性随机对照临床试验数据,现有的证据大多来源于回顾性研究或小规模研究。在治疗过程中,多学科团队发挥着至关重要的作用。治疗手段包括手术、放射治疗、化疗、射频消融(RFA)以及生物制剂等。 对于术后复发的胃癌患者,治疗主要侧重于个体化的局部治疗方案,同时,同步放疗与化疗的结合已被证明能显著延长患者的生存时间;对于初次诊断时仅有单一转移的胃癌患者,腹主动脉旁淋巴结转移的患者通过手术联合化疗可以取得较好的效果,肝转移患者若进行手术切除,其预后通常优于未接受手术的患者。卵巢转移的患者治疗策略包括系统性化疗和选择性卵巢切除术。对于腹膜转移的患者,主要采用系统性化疗,同时区域性化疗方法如腹腔灌注化疗(IP)和腹腔热灌注化疗(HIPEC)也在临床实践中得到应用。 此外,新辅助治疗在局部进展期胃癌的综合治疗中扮演着关键角色,主要适用于cT3/N+或更高级别的胃癌患者,目的是提升R0切除率并减少复发的可能性。 目前,胃癌新辅助化疗的常用方案包括ECF(表柔比星+顺铂+氟尿嘧啶)、FLOT(多西他赛+奥沙利铂+氟尿嘧啶)、SOX(替吉奥联合奥沙利铂)、SP(替吉奥联合顺铂)和DOSS(多西他赛+奥沙利铂+替吉奥)等。对于那些在新辅助治疗后达到临床或病理完全缓解的患者,尽管存在复发风险,建议术后继续使用术前有效的化疗方案作为辅助治疗,但剂量应适当调整;特别是对于临床完全缓解的胃癌患者,建议进行根治性手术;对于新辅助治疗后肿瘤缩小或降期的胃癌患者,应根据初始情况实施切除;对于食管胃结合部肿瘤,推荐进行常规的D2淋巴结清扫,并努力实现R0切除。 与传统化疗相比,靶向治疗因其更高的选择性和针对性,能够提升治疗效果和改善患者的生活质量。目前,胃癌靶向治疗药物主要包括曲妥珠单抗和阿帕替尼等。曲妥珠单抗适用于HER2过表达的胃癌患者,与化疗药物联合使用,可以显著提高患者的长期生存率。阿帕替尼与化疗联合使用,能够提高胃癌降期率,延长生存时间。 2024年,针对CLDN18.2的胃癌靶向治疗也取得了进展。在SPOTLIGH研究和GLOW研究中显示:CLDN18.2的人源化单克隆抗体佐妥昔单抗(Zolbetuximab)与化疗药物联合使用,显示出良好的临床疗效。佐妥昔单抗联合化疗有望成为CLDN18.2阳性、HER2阴性胃癌患者新的靶向治疗方案。 ▲CLDN18.2的结构 图源:搜狐 随着医学界对肿瘤复发转移理论的深入研究和新检测技术的不断涌现,精确预防和干预胃癌复发转移有望成为未来取得突破性进展的重要领域之一。目前,临床上主要使用的胃癌免疫治疗药物是免疫检查点抑制剂。 肿瘤免疫疗法,尤其是针对程序性细胞死亡1(PD-1)和程序性死亡配体1(PD-L1)的治疗在临床试验中实现了重大进展,并为多种癌症患者带来了益处。但胃癌患者对这类免疫疗法的反应表现出显著差异。因此,探究胃癌中PD-1/PD-L1表达的调控机制,并开发新的联合疗法以提升免疫检查点抑制剂的效果,显得尤为关键。 在相关研究中,研究者发现IKAROS家族锌指蛋白4(IKZF4)和非POU结构域八聚体结合蛋白(NONO)共同作用,增强了胃癌中RAB11家族相互作用蛋白3(RAB11FIP3)的表达。IKZF4/NONO-RAB11FIP3通路促进了PD-L1的内体回收,特别是在胃癌细胞膜上。RAB11FIP3过度表达能缓解IKZF4或NONO缺失导致的PD-L1蛋白表达降低。沉默RAB11FIP3或IKZF4能够促进T细胞的增殖,并加强体外T细胞对胃癌细胞的细胞毒性,通过增加CD8+T细胞在肿瘤微环境中的浸润来抑制小鼠肿瘤免疫逃逸,进而抑制胃癌的发展。通过这些研究发现不仅阐明了胃癌进展和肿瘤免疫逃逸的分子机制,而且为胃癌患者提供了新的潜在治疗靶点。 为了降低胃癌术后复发风险 以下预防策略至关重要 现在,肿瘤治疗已经迈入了精准医学的新纪元。随着对肿瘤复发和转移机制的深入理解以及新检测技术的开发,早期胃癌的复发和转移预防、精确检测以及早期治疗成为了胃癌临床和转化医学研究的关键领域。以循环肿瘤细胞(CTC)和循环肿瘤DNA(ctDNA)检测为核心的液体活检技术,对于监测早期胃癌的远处转移和复发具有显著的潜力。同时,基于肿瘤免疫系统的基础和临床研究,专注于如何改善胃癌患者的系统免疫状态,可能会成为未来预防和治疗早期胃癌复发和转移取得重大进展的关键方向。 此外,胃癌根治性手术后的主要复发形式为腹膜复发,且其预后通常较差。对于哪些患者可能从强化治疗中获益,准确的个体化腹膜复发预测显得至关重要。 图源:参考文献【8】 2022年,在《柳叶刀-数字医疗》杂志发布了一项研究,该研究利用人工智能的多任务训练模型来预测胃癌患者术后腹膜复发和无病生存期。研究人员开发了一种多任务深度学习模型,该模型能够通过术前CT图像精确地预测腹膜复发和无病生存期,并在多个中心的内外部数据集中验证了其卓越的性能。借助人工智能模型,临床医生在预测腹膜复发方面的准确性得到了显著提升。另外,该人工智能模型还能识别出II、III期胃癌患者中哪些人最有可能从辅助化疗中受益。这项模型的开发可能会对胃癌的个性化治疗提供指导,并帮助选择最有可能从新疗法,如腹腔热灌注化疗中获益的患者。 可愈有道通过专业的医学服务团队和广泛的国际医疗资源,帮助患者在全球范围内寻找优质权威的抗癌治疗方向,真正实现健康的全球化管理,不仅可以让患者更安心地进行治疗,也能保证患者及时获得有效的治疗方案,实现更好的预后,提高生存率和生活质量。如需要了解更多胃癌治疗相关内容,或有意向咨询世界权威胃癌治疗专家进行诊治,可通过热线400-678-6998直接联系小愈进行咨询。 注:图源:摄图网 参考文献: [1]Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021. [2]IKZF4/NONO-RAB11FIP3 axis promotes immune evasion in gastric cancer via facilitating PD-L1 endosome recycling https://www.sciencedirect.com/science/article/pii/S0304383524000120 [3]早期胃癌复发因素和模式[J]. 中国实用外科杂志, 2022. [4]日本《胃癌治疗指南(第6版)》拔萃[J]. 中国实用外科杂志, 2021 [5]中华医学会胃癌临床诊疗指南(2021版)[J]. 中华医学会杂, 2022 [6]胃癌诊治难点中国专家共识 (2020版)[J]. 中国实用外科杂志, 2020 [7]Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial https://www.nature.com/articles/s41591-023-02465-7 [8]Predicting peritoneal recurrence and disease-free survival from CT images in gastric cancer with multitask deep learning: a retrospective study https://www.thelancet.com/journals/landig/article/PIIS2589-7500(22)00040-1/fulltext