第一三共制药的EZH1/2双重抑制剂EZHARMIA在日本获得了第二个适应症批准,用于治疗复发或难治性外周T细胞淋巴瘤(PTCL)成人患者。
图源:第一三共官网
PTCL是一种罕见但侵袭程度较高的血液系统肿瘤,占全部非霍奇金淋巴瘤的10-15%,在亚洲地区相对高发。大多数 PTCL 患者在接受以多药化疗为基础的初始治疗后,疾病会出现进展,复发后的中位总生存期约为 5.8 个月。日本厚生劳动省(MHLW)批准 EZHARMIA 的依据是VALENTINE-PTCL01 2期试验结果。该结果已在 2023 年美国血液学会年会上公布。在VALENTINE-PTCL01试验中,119 例复发或难治性 PTCL 患者中,客观缓解率(ORR)达到43.7%,以及17例完全缓解(CRs)和35例部分缓解(PRs)。在多种PTCL亚型中均有反应,包括血管免疫母细胞t细胞淋巴瘤(AITL)、未另行指定的PTCL(PTCL-nos)和其他PTCL亚型。
日本第一三共研发部门主任东参里博士说:“日本的外周适应症是治疗周围T细胞淋巴瘤的重要进展,因为需要新的有效的治疗方案来改善患者的预后。”“这是第一三共正在进行的创新研究的例证,旨在创造有可能改变癌症患者护理标准的新药。”EZHARMIA在VALENTINE-PTCL01中表现出的安全性与之前的临床试验一致。133例患者中有106例(79.7%)发生了与治疗相关的不良事件,最常见的事件包括血小板计数下降(44.4%)、贫血(27.1%)、味觉障碍(24.8%)和中性粒细胞计数下降(21.1%)。
关于VALENTINE-PTCL01试验
VALENTINE-PTCL01试验是全球、开放标签、单臂、双队列2期研究评估EZHARMIA用于复发或难治性PTCL和成人t细胞白血病/淋巴瘤(ATLL)患者的有效性和安全性,且患者已接受至少一个系统治疗并且不符合造血干细胞移植的条件。一组纳入了PTCL患者,第二组纳入了ATLL患者。
图源:第一三共官网
VALENTINE-PTCL01的主要终点是客观缓解率ORR。次要终点包括缓解持续时间、CR、PR、CR持续时间和无进展生存期——均通过BICR和研究者评估进行评估——以及由研究者评估的ORR、总生存期、安全性和药代动力学。探索性终点包括基于pet-ct的BICR和生物标志物突变状态。VALENTINE-PTCL01在亚洲、欧洲、北美和大洋洲的多个地点招募了133名患者。
关于外周T细胞淋巴瘤
PTCL是一组罕见且具有侵袭性的血液系统肿瘤,占所有非霍奇金淋巴瘤的10-15%。2022年,全球约有55.3万例NHL新诊断病例。至少有29种已知的PTCL亚型,具有显著的地区分布差异。与世界其他地区相比,PTCL在亚洲更为常见。PTCL的预后一般较差,AITL和PTCL-NOS的5年总生存率为32%,某些亚型为7%或更低。大多数PTCL患者在接受基于多药物化疗方案的初始治疗后经历了疾病进展,复发后的中位总生存期约为5.8个月。开发更有效的PTCL药物仍然是一种未满足的临床需求,特别是在复发或难治性的情况下。
关于EZH1和EZH2
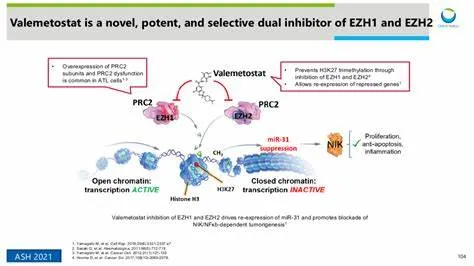
EZH2及其高度相关的同源基因EZH1被认为是表观遗传沉默因子,它们作为多梳抑制性复合体2(PRC2)的核心成分,在细胞的生长和分化中起着关键作用。EZH1和EZH2在人类恶性肿瘤中起作用,这两个基因的变化与人类恶性肿瘤的转化有关。这两种分子的突变和过表达可导致血液系统恶性肿瘤,包括T细胞淋巴瘤,研究表明它们有助于肿瘤抑制基因的沉默并驱动致癌生长。
关于EZHARMIA
EZHARMIA(valemetostat tosilate,甲苯磺酸伐美妥司他)是全球首个获得批准用于该适应症的双重EZH1和EZH2抑制剂,EZH1/2是参与基因表达的酶。Valemetostat被认为通过抑制EZH1/2的甲基化活性来表现出肿瘤生长抑制作用,EZH1/2反过来又抑制组蛋白H327位赖氨酸残基的甲基化。然而,详细的作用机制尚未阐明。EZHARMIA仅在日本上市,在其他地区仍处于临床试验阶段。
参考资料:
https://www.daiichisankyo.com/files/news/pressrelease/pdf/202406/20240624_E2.pdf
【可愈有道】是国内权威的海外医疗咨询服务机构,拥有全球多家知名医院的合作转诊医疗资源。如果您想要快速办理美国/日本/英国等国家出国看病、国际专家远程咨询、日本体检等业务,欢迎拨打免费热线:400-678-6998 进行咨询。