11月8日,中国国家药监局(NMPA)官网公布了一项重要消息,合源生物提交的CAR-T细胞疗法产品纳基奥仑赛注射液(曾用名:赫基仑赛)已获得批准,可用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。这是中国首款获批上市用于治疗白血病的CAR-T疗法产品。
纳基奥仑赛注射液(CNCT19细胞注射液)是一种CAR-T细胞疗法,它专门针对CD19靶标,拥有创新的CD19 scFv(HI19a)结构。该药物已在中国获得多项临床试验批准,适用于成人复发或难治性ALL、复发或难治性侵袭性B细胞非霍奇金淋巴瘤以及儿童和青少年复发或难治B细胞型ALL。其中,纳基奥仑赛用于复发或难治性ALL的申请还被NMPA列为突破性治疗品种。
纳基奥仑赛的上市申请基于一项关键性的单臂、开放式、多中心临床研究,旨在治疗成人复发或难治性B细胞型急性淋巴细胞白血病。该研究由中国医学科学院血液病医院的王建祥教授作为主要研究者,在中国的10家临床中心进行。在2022年12月举行的第64届美国血液学年会(ASH)上,研究人员通过口头报告发布了这一关键临床研究的数据。截至2022年9月27日,有39名成人r/r B-ALL患者接受了纳基奥仑赛注射液的治疗。具体试验数据如下:
患者表现出持久的高缓解率,总缓解率达到82.1%。在中位随访9.3个月时,中位缓解持续时间尚未达到,而在3个月后仍处于缓解状态的患者中,1年后有望有80%的患者继续保持缓解状态,无论是否接受造血干细胞移植,均能够获得持续缓解和长期生存的益处。
与CAR-T治疗相关的毒性反应明显降低,3级及以上的细胞因子风暴(CRS)发生率为10.3%,而3级及以上的免疫效应细胞相关神经毒性综合征(ICANS)发生率为7.7%。此外,未出现预期之外的靶向CD19 CAR-T治疗导致的不良事件。
今年3月,美国FDA也已批准了纳基奥仑赛注射液用于治疗成人复发或难治性B细胞型急性淋巴细胞白血病(B-ALL)的IND(Investigational New Drug)申请。我们期望纳基奥仑赛注射液的其他临床研究也能够顺利进行,以早日造福更多患者。
可愈有道努力推动国际医学合作,为更多需要帮助的患者朋友们带来健康和希望,我们与海外多家知名医院保持着紧密的合作关系,如果您需要咨询或寻求专业意见,可以致电我们的客服热线:400-678-6998,或扫描二维码联系我们。
参考资料:
[1]国家药监局附条件批准纳基奥仑赛注射液上市 . Retrieved Nov 8,2023, from https://www.nmpa.gov.cn/zhuanti/cxylqx/cxypxx/20231108092415187.html
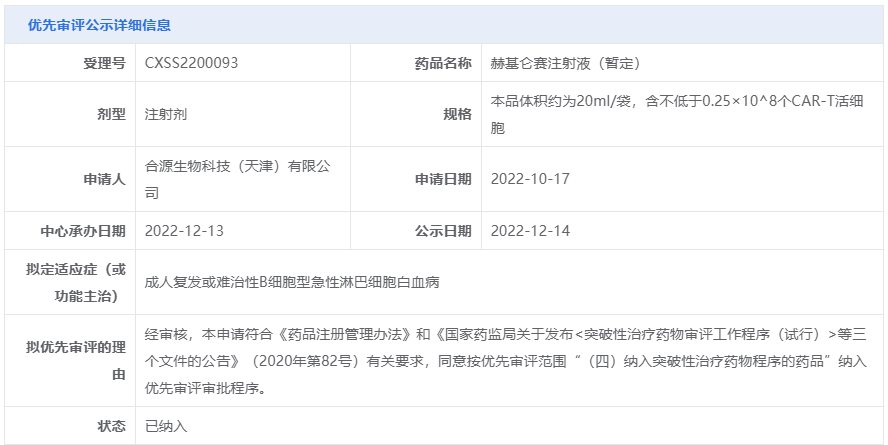
[2]合源生物赫基仑赛注射液新药上市申请获国家药品监督管理局正式受理.
Retrieved Dec 14, 2022.
From https://mp.weixin.qq.com/s/1vBGtbZrvffxJkEe3pqK9A
[3]合源生物CAR-T新药赫基仑赛注射液IND申请获美国FDA许可.
Retrieved Mar 14, 2023.
From https://mp.weixin.qq.com/s/IZ9WyevsyrHy80dz8SItAQ
免责声明:公司所提供的信息均来源于网络上公开发表的文献或文章,仅供用户参考使用。本公司力求为用户提供准确、客观的信息资料与数据,用户据信息作出的选择和判断,公司不承担任何经济与法律责任。