安斯泰来高级副总裁兼免疫肿瘤学领域开发负责人、医学博士Moitreyee Chatterjee-Kishore表示:“在全世界范围内,中国的胃癌新发病例几乎占了一半。根据2020年的数据,中国新增的胃癌患者超过了478,000例,死亡病例更是高达373,000例。
Zolbetuximab上市许可申请是基于GLOW和SPOTLIGHT两项III期临床试验结果:
GLOW试验的目标在于全面评估zolbetuximab与CAPOX联合疗法(其中包括卡培他滨和奥沙利铂的联合化疗方案)相较于安慰剂联合CAPOX的疗效。值得关注的是,这项研究涵盖了中国大陆共计145名患者,从而确保了在本地患者群体中的应用情况得到充分考虑。
SPOTLIGHT试验则专注于评价zolbetuximab与mFOLFOX6联合疗法(其中包括奥沙利铂、亚叶酸以及经过改良的5-氟尿嘧啶的联合化疗方案)与安慰剂联合mFOLFOX6的疗效差异。在这个试验中,中国大陆的36名参与患者为研究提供了重要的数据。这两项试验的数据对于Zolbetuximab的上市申请提供了有力的支持,同时也为中国晚期胃癌患者带来了新的治疗前景。
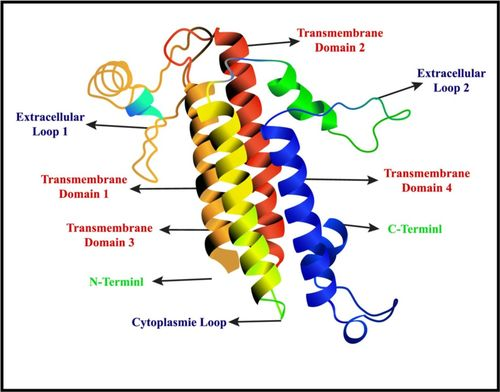
Zolbetuximab是一种在研的靶向CLDN18.2的首创嵌合IgG1单克隆抗体(mAb),可与CLDN18.2跨膜蛋白结合。Zolbetuximab通过与胃癌细胞表面的CLDN18.2分子结合,发挥其疗效。经过临床前的研究表明,这种结合作用随后会激活两种不同的免疫系统途径,分别是抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC),从而诱导胃癌细胞死亡。这种多重作用机制为Zolbetuximab在胃癌治疗中的潜在效果提供了坚实的理论基础。
今年6月9日,安斯泰来制药集团已向日本厚生劳动省(MHLW)提交了zolbetuximab的新药上市申请;
今年7月6日安斯泰来(Astellas Pharma)宣布,美国FDA已经接受了zolbetuximab的生物制品许可申请(BLA),并授予其优先审评资格;
随后7月13日,安斯泰来制药公司Zolbetuximab的上市许可申请也获得欧洲药品管理局(EMA)受理。
胃癌作为我国常见的恶性肿瘤之一,多年来一直居恶性肿瘤发病率和死亡率的第三位。这个严峻的现实使胃癌成为我国医学和公共卫生领域亟需应对的重要问题。据统计,在中国,约有80%的胃癌患者在初次确诊时已经处于局部进展期,甚至已经进展到晚期。zolbetuximab作为一种针对CLDN18.2的治疗药物一旦获得批准,不仅为胃癌患者带来了新的治疗希望,也为临床医生提供了更多的治疗选择。
获取更多关于胃癌治疗和新药相关信息,请咨询可愈有道。