2024年的最后两个月里,全球抗癌新药研发的步伐依然紧锣密鼓,多款备受期待的新药有望获批上市。这些创新药物、新技术可能为肿瘤患者带来突破性的治疗选择。这不仅是患者的希望,更是科学进步的见证,我们期待这些新药为癌症治疗开创更多可能,让生命延续的梦想不再遥远。


靶点:TROP2(滋养层细胞表面抗原2)
适应症:非小细胞肺癌(NSCLC)、乳腺癌、尿路上皮癌
转移性乳腺癌、三阴性乳腺癌;
化疗及免疫治疗后进展的转移性尿路上皮癌。
近期,芦康沙妥珠单抗被中国国家药品监督管理局(NMPA)纳入优先审评程序,用于治疗以下患者:
1.不可切除的局部晚期或转移性三阴性乳腺癌;
2.局部晚期或转移性EGFR突变的非小细胞肺癌。
如果顺利获批,这将成为中国首款原创治疗肺癌的TROP2靶向抗体偶联药物,为肺癌患者带来新希望。
芦康沙妥珠单抗在治疗转移性乳腺癌的TROPiCS-02研究(NCT04639986)中,显示出显著的临床疗效。研究共招募331例HR+HER2−转移性乳腺癌患者,将其分为两组:
SG组(166例,接受芦康沙妥珠单抗治疗);
化疗组(165例)。
无进展生存期(PFS):
中位PFS:4.3个月(SG组) vs 4.2个月(化疗组);
6个月PFS率:41%(SG组) vs 24%(化疗组);
节点分析显示,与化疗相比,芦康沙妥珠单抗治疗使疾病进展或死亡风险降低了34%。
日本美国专家线上远程咨询
▼

芦康沙妥珠单抗在HR+HER2−转移性乳腺癌中展现出优于传统化疗的疗效,为患者提供了延缓病情进展的重要治疗选择。

靶点:CD19
适应症:复发/难治性B细胞急性淋巴细胞白血病(R/R B-ALL)
Obe-cel是一款以CD19为靶点的自体CAR-T细胞治疗产品,旨在通过基因工程技术改造患者自身的T细胞,使其能够精准识别并杀伤表达CD19的B细胞恶性肿瘤细胞。
目前,Obe-cel的生物制品许可申请(BLA)已被美国食品药品监督管理局(FDA)受理,用于治疗成人复发/难治性(R/R)B细胞急性淋巴细胞白血病(B-ALL)。此外,该药已获得美国FDA和欧洲药品管理局(EMA)授予的孤儿药资格认定,彰显其在治疗稀有恶性疾病中的潜在价值。
Obe-cel的BLA申请基于FELIX研究(NCT04404660)的2期临床试验数据,该研究结果在2023年美国临床肿瘤学会(ASCO)年会和美国血液学会(ASH)年会上公布,显示出令人振奋的疗效。
研究设计:入组126例复发/难治性B细胞急性淋巴细胞白血病患者,所有患者均接受Obe-cel治疗。
随访时间:截至2023年3月16日,中位随访时间为11.0个月。
疗效数据:
CR/CRi率(完全缓解或完全缓解但计数未完全恢复):77%;
CR率(完全缓解):57%;
MRD阴性率(微小残留病灶阴性):在可评估患者中高达96%。
这些结果表明,Obe-cel在R/R B-ALL患者中具有强大的抗肿瘤活性,能够显著提高缓解率,并降低疾病的复发风险。


图源:摄图网
靶点:HER2(人类表皮生长因子受体2)
适应症:不可切除的、局部晚期或转移性HER2阳性胆道癌(BTC)
Zanidatamab是一款靶向HER2的双特异性抗体,具有同时结合HER2不同表位的能力,从而更高效地阻断肿瘤细胞信号通路,并促进抗体依赖性细胞毒性(ADCC)。
该药主要用于治疗先前接受过治疗的、不可切除的、局部晚期或转移性HER2阳性胆道癌(BTC),包括胆囊癌(GBC)、肝内胆管癌(ICC)、肝外胆管癌(ECC)。2024年5月29日,美国食品药品监督管理局(FDA)授予其优先审查资格。如果顺利获批,Zanidatamab将成为首个专门用于HER2阳性胆道癌的FDA批准药物,为这一高需求领域的患者提供新的治疗选择。
Zanidatamab的生物制品许可申请(BLA)主要基于2b期HERIZON-BTC-01研究(NCT04466891)的显著疗效。
研究设计:入组87例不可切除、局部晚期或转移性HER2阳性胆道癌患者,接受Zanidatamab治疗。其中,队列1(n=80)患者数据用于疗效分析。
疗效结果:
客观缓解率(ORR):41%;
中位缓解持续时间(DOR):12.9个月;
数据截止时(2022年10月10日),33例应答者中:
49%患者持续缓解;
82% 患者的DOR≥16周。



图源:摄图网
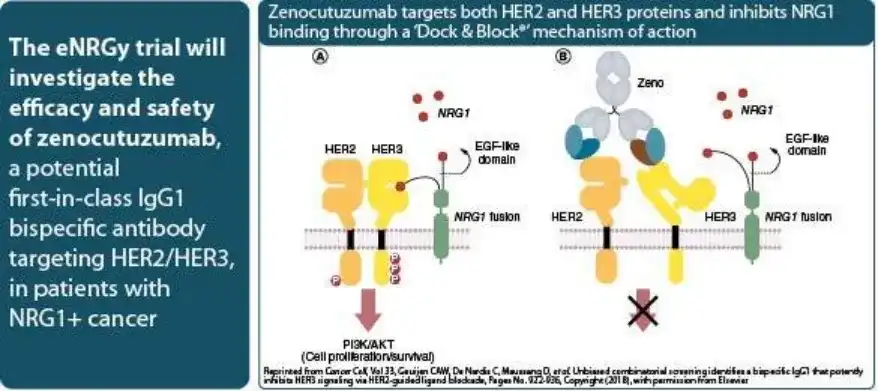
靶点:HER2、HER3
适应症:NRG1阳性非小细胞肺癌(NSCLC)或胰腺癌(PDAC)
Zenocutuzumab是一款由Merus公司研发的双特异性抗体,靶向HER2和HER3。该药物通过阻断HER3与NRG1(神经调节蛋白1融合基因)介导的信号通路,抑制肿瘤细胞的生长和增殖。
目前,Zenocutuzumab的生物制品许可申请(BLA)已获得美国食品药品监督管理局(FDA)授予的优先审查资格,用于治疗NRG1阳性非小细胞肺癌(NSCLC)或胰腺癌(PDAC)。优先审查将审查周期从常规的10个月缩短至6个月。如果顺利获批,该药将成为全球首个专门针对NRG1阳性肺癌和胰腺癌的靶向疗法,为这一患者群体提供新的治疗选择和生存希望。
Zenocutuzumab的疗效数据主要来源于1/2期eNRGy临床研究(NCT02912949)。
研究设计:入组85例晚期NRG1阳性非小细胞肺癌(NSCLC)患者,所有患者均为年龄≥18岁,且既往已接受标准疗法或不适合标准疗法的治疗。
疗效数据:
客观缓解率(ORR):37.2%(29/78,95% CI 26.5-48.9);
靶病变缩小率:78%的患者显示靶病变缩小;
中位缓解持续时间(DOR):12.9个月;
6个月DOR率:79%。
这些数据表明,Zenocutuzumab对NRG1阳性NSCLC患者具有显著的抗肿瘤活性,特别是在改善疾病控制和缓解持续性方面具有突出优势。
图源:https://www.tandfonline.com/doi/full/10.2217/fon-2023-0824#abstract
【可愈有道】是国内权威的海外医疗咨询服务机构,拥有全球多家知名医院的合作转诊医疗资源。如果您想要快速办理美国/日本/英国等国家出国看病、国际专家远程咨询、日本体检等业务,欢迎拨打免费热线:400-678-6998 进行咨询!
参考资料:
1.https://ascopubs.org/doi/10.1200/JCO.2023.41.16_suppl.4008
2.Future Oncol. 2024;20(16):1057-1067. doi: 10.2217/fon-2023-0824. Epub 2024 Feb 13.
https://www.tandfonline.com/doi/full/10.2217/fon-2023-0824#abstract
3.Lancet. 2023 Oct 21;402(10411):1423-1433. doi: 10.1016/S0140-6736(23)01245-X. Epub 2023 Aug 23.
4.Cancer Manag Res
5.. 2024 Nov 14:16:1587-1596. doi: 10.2147/CMAR.S379807. eCollection 2024.

