双特异性抗体(Bispecific antibodies,BsAb),是通过细胞融合、重组DNA、蛋白质工程等技术制备的人工抗体,可以同时或先后特异性结合两种抗原或同一抗原的两个不同表位,简称双抗。
图源:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10501874/
过去三十年来,由于其特异性和敏感性,治疗性抗体已成为癌症治疗的关键组成部分。第一个单克隆抗体Muromonab-CD3(OKT3)于1986年获批上市。从那时起,基于抗体的药物迅速发展,成为最重要的药物类型之一。在肿瘤治疗中,单克隆抗体药物展现出卓越的疗效,例如Rituximab(抗CD20)和Trastuzumab(抗HER2),它们已被批准用于治疗B细胞恶性肿瘤和乳腺癌,并且取得了令人鼓舞的结果。
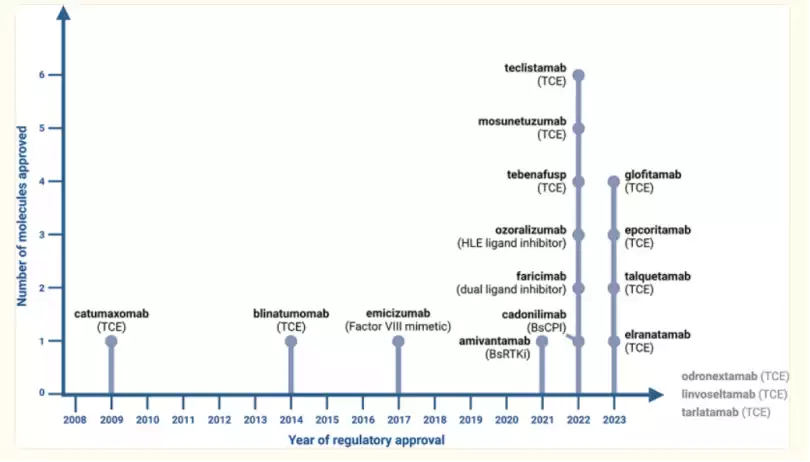
由于过去二十年来对这些分子的浓厚兴趣以及开发技术的进步,已经有数百种双特异性抗体(bsAbs)被描述、通过各种不同的技术进行工程设计并在临床前开发。其中,超过100种双特异性抗体已进入临床试验。基于这些在开发新型双特异性抗体格式、靶点组合和双特异性引导分子方面的巨大努力,双特异性抗体的领域在近期发生了显著变化,自2021年以来,双特异性抗体的批准变得越来越频繁。在过去三年(2021-2023年)中,仅在美国、欧洲、日本和中国,就有11种新型双特异性抗体获得了卫生当局的批准并用于患者治疗。
在这11种双特异性抗体中,有9种用于癌症治疗,例如:
EGFR/c-MET双特异性抗体Amivantamab(强生)用于治疗具有EGFR外显子20插入突变的非小细胞肺癌(NSCLC);
gp100-pMHC/CD3ε双特异性抗体Tebentafusp(Immunocore)用于治疗不可切除或转移性葡萄膜黑色素瘤;
CD20/CD3ε T细胞引导抗体Mosunetuzumab(罗氏集团)用于治疗复发/难治性(R/R)滤泡性淋巴瘤;
PD-1/CTLA-4双特异性抗体Cadonilimab(康方生物)用于治疗复发或转移性宫颈癌患者;
BCMA/CD3ε T细胞引导抗体Teclistamab(强生)用于治疗R/R多发性骨髓瘤;
CD20/CD3ε T细胞引导抗体Glofitamab(罗氏集团)用于治疗R/R弥漫性大B细胞淋巴瘤(DLBCL);
CD20/CD3ε T细胞引导抗体Epcoritamab(AbbVie/Genmab)用于治疗R/R DLBCL;
GPRC5D/CD3ε T细胞引导抗体Talquetamab(强生)用于治疗R/R多发性骨髓瘤;
BCMA/CD3ε T细胞引导抗体Elranatamab(辉瑞)用于治疗R/R多发性骨髓瘤。
另外两种双特异性抗体被批准用于非肿瘤适应症,即VEGF-A/Ang-2双特异性抗体Faricimab(罗氏集团)用于治疗湿性年龄相关性黄斑变性、糖尿病黄斑水肿以及视网膜静脉阻塞后黄斑水肿;以及TNF/人血清白蛋白(HSA)双特异性抗体Ozoralizumab(大正制药)用于治疗管理不佳的类风湿性关节炎。
>目前,罗氏集团和中外制药公司在这一领域处于领先地位,拥有四种获批的双特异性抗体,其次是强生,拥有三种获批的双特异性抗体。值得注意的是,在目前已获批的13种双特异性抗体中,有两种(Emicizumab和Faricimab)已达到“重磅炸弹”级别,年销售额分别超过40亿美元和20亿美元,这也凸显了这种新型疗法的商业潜力。
图源:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10936642/
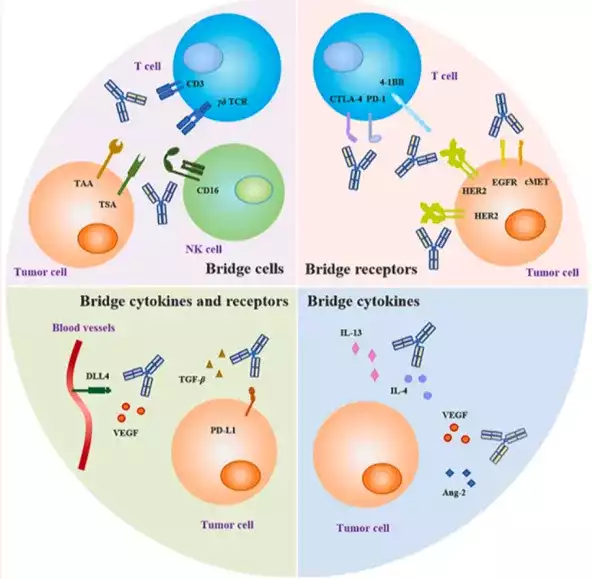
引导免疫细胞攻击肿瘤:双抗的特殊构造可以同时连接肿瘤细胞和免疫细胞。一侧的抗原结合臂抓住肿瘤细胞,另一侧抓住免疫细胞,激活免疫细胞去攻击和消灭肿瘤。
更强的免疫激活:双抗能够同时激活两种不同的免疫受体,或者一边激活,一边抑制某种受体,这使得免疫细胞比使用单抗时更加活跃,能够更有效地对抗癌症。
防止癌细胞耐药:癌细胞有时会通过开启备用的生长信号通路来躲避治疗。双抗可以同时阻断这些备用通路中的多个关键信号,使得癌细胞更难产生耐药性,从而提高治疗效果。
更精确的肿瘤靶向,减少副作用:双抗可以同时识别和结合两种不同的肿瘤标记物,这使得它们能够更精确地找到并攻击肿瘤细胞,同时减少对健康细胞的攻击,从而降低副作用。
通过这些技术优势,双特异性抗体有望在癌症治疗中发挥更大作用,带来更好的疗效和更少的副作用。
双特异性抗体的研究具有独特性,且越来越多的研究机构参与其中,因此需要行业指导原则来规范研究和开发,指出潜在的挑战,以确保研究成功。
美国食品药品监督管理局(FDA)于2019年4月19日首次发布了《双特异性抗体开发项目指南》的草案,并在2021年5月24日发布了最终版本。随后,在2022年4月11日,中国国家药品监督管理局(NMPA)发布了《双特异性抗体类抗肿瘤药物临床开发技术指导原则(征求意见稿)》,并在2022年11月9日发布了最终版本。这标志着双特异性抗体从“野蛮生长阶段”进入了更加“科学发展的阶段”。
目前,欧盟尚未发布针对双特异性抗体药物的专门指南,因此这类药物的开发仍遵循治疗性蛋白药物的相关指导原则。
全球市场对双特异性抗体的需求正在快速增长,预计到2027年,与癌症相关的双特异性抗体销售额将达到37亿美元。尽管仍存在一些挑战,但双特异性抗体凭借其独特的优势成为了一种强大的治疗武器。这些优势包括提高疗效、降低毒性以及改善靶向性,从而有助于提升癌症治疗的效果。
【可愈有道】是国内权威的海外医疗咨询服务机构,拥有全球多家知名医院的合作转诊医疗资源。如果您想要快速办理美国/日本/英国等国家出国看病、国际专家远程咨询、日本体检等业务,欢迎拨打免费热线:400-678-6998 进行咨询!
参考资料:
1、Nat Rev Drug Discov. 2024 Apr;23(4):301-319. doi: 10.1038/s41573-024-00896-6. Epub 2024 Mar 6.
2、https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10501874/
3、https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10936642/

