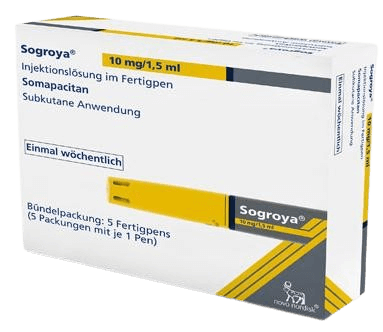
Sogroya(somapacitan):欧盟权威批准用于成人生长激素缺乏症的革新性每周一次长效疗法
2023年5月26日,丹麦医药巨头诺和诺德宣布,其研发的长效生长激素疗法Sogroya(somapacitan)已获得欧盟委员会(EC)批准,用于治疗三岁及以上儿童因内源性生长激素(GH)缺乏引起的生长发育迟缓以及青少年的生长衰竭。这一突破性的每周一次皮下注射方案旨在减轻当前每日注射带来的不便,提高患者依从性,并改善生活质量
2024年01月31日