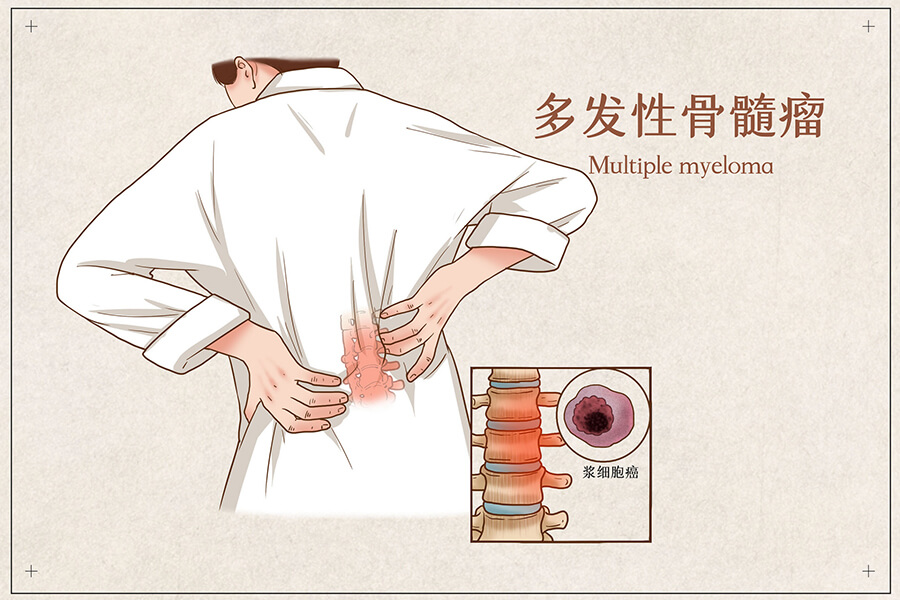
日本批准Lumykras上市,治疗KRAS G12C肺癌
2022年1月20日,安进公司的靶向抗癌药Lumakras(sotorasib,AMG 510)获得了日本厚生劳动省的批准。这款药物是一种首创的KRASG12C抑制剂,用于治疗KRAS G12C突变阳性、不可切除性、晚期和/或复发性非小细胞肺癌(NSCLC)患者。
2023年12月21日