关键摘要
1、欧洲药品管理局CHMP批准特瑞普利单抗联合顺铂和吉西他滨,用于复发、无法接受手术或放疗或转移性鼻咽癌(NPC)成年患者的一线治疗。
2、以上批准意见基于 3 期 JUPITER-02 试验的循证医学结果,接受特瑞普利单抗联合化疗的患者比单纯化疗的患者的中位无进展生存期长了约13个月,2年中疾病进展的发生率也大大降低。
3、欧洲药品管理局CHMP批准特瑞普利单抗与顺铂和紫杉醇联合用于不可
切除的晚期、复发性或转移性食管鳞状细胞癌(ESCC)成年患者的一线治疗。
4、以上批准意见基于 3 期 JUPITER-06 试验的循证医学结果,接受特瑞普利单抗联合化疗的患者比单纯化疗的患者的中位生存期长了近半年。
图源:摄图网
详细信息
欧洲药品管理局人用药品委员会(CHMP)建议批准特瑞普利单抗toripalimab-tpzi(Loqtorzi)联合顺铂和吉西他滨,用于复发、无法接受手术或放疗或转移性鼻咽癌(NPC)成年患者的一线治疗;以及批准特瑞普利单抗与顺铂和紫杉醇联合用于不可切除的晚期、复发性或转移性食管鳞状细胞癌(ESCC)成年患者的一线治疗。
对鼻咽癌适应症的推荐基于 3 期 JUPITER-02 试验(NCT03581786)的数据,而对 ESCC 适应症的肯定意见则是出于 3 期 JUPITER-06 试验(NCT03829969)结果的支持。
“君实生物总经理兼首席执行官、医学博士邹建军在一份新闻稿中表示:"作为中国领先的创新型制药公司,君实生物致力于满足本地患者的临床需求,并为全球患者提供可带来生存获益的新型疗法。特瑞普利单抗有望改善他们的治疗选择。CHMP的积极意见让我们离这一目标更近了一步。我们将继续与当地监管机构沟通,让我们的创新疗法尽快造福更多欧洲患者。”
2023 年 10 月,FDA 批准特瑞普利单抗与顺铂和吉西他滨联用,用于转移性或复发性局部晚期鼻咽癌成人患者的一线治疗,并批准其作为单药用于治疗复发性、不可切除性或转移性鼻咽癌成人患者,这些患者在接受含铂化疗时或化疗后疾病出现进展。
JUPITER-02
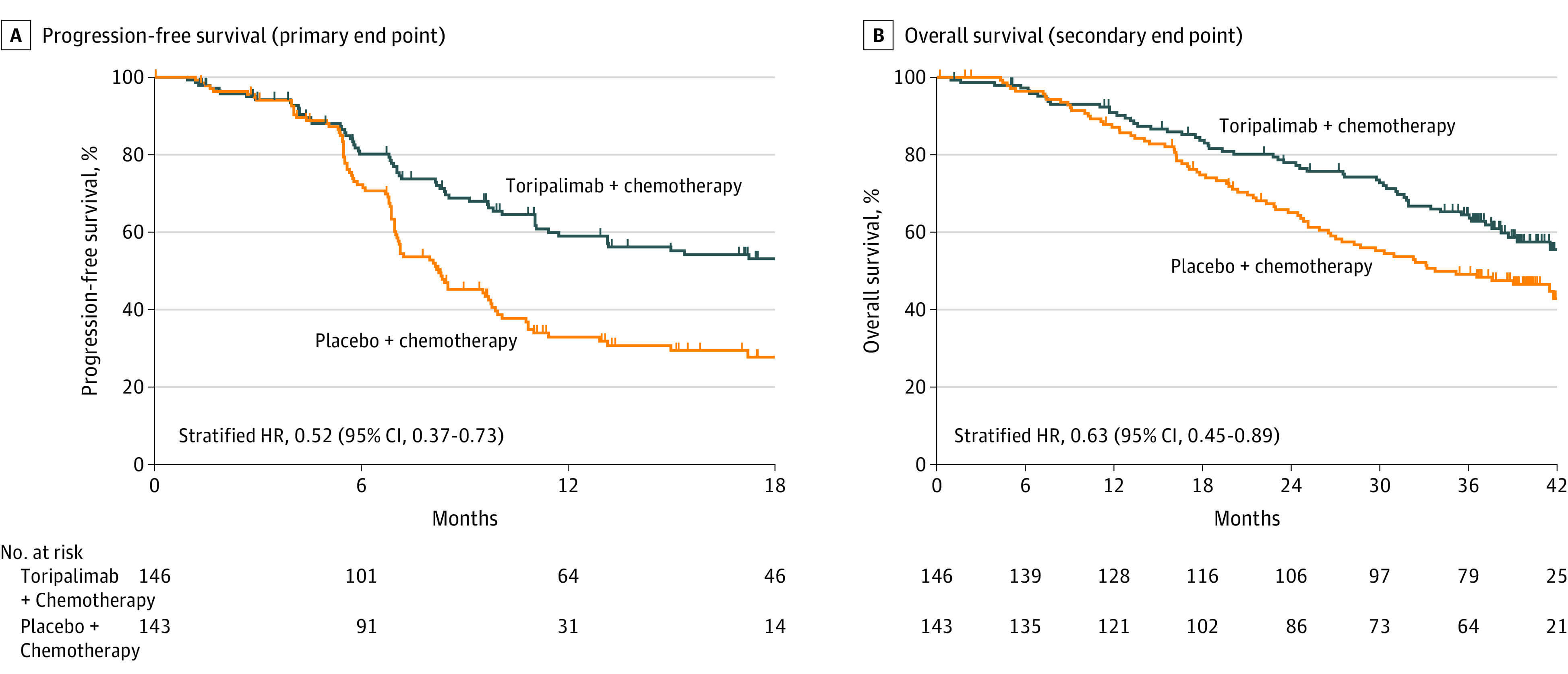
国际多中心随机双盲 JUPITER-02 试验招募了复发性或转移性鼻咽癌患者,这些患者之前未接受过复发性/转移性系统化疗。研究结果显示,接受特瑞普利单抗联合化疗的患者(n = 146)的中位无进展生存期(PFS)为21.4个月,而接受安慰剂联合化疗的患者(n = 143;HR,0.52;95% CI,0.37-0.73;名义P < .001)为8.2个月。特瑞普利单抗治疗组的1年和2年PFS率分别为59.0%和44.8%,而安慰剂组分别为32.9%和25.4%。
图源:参考资料[3]
研究人员招募了年龄在 18 至 75 岁之间、组织学或细胞学确诊为原发性复发性或转移性鼻咽癌且无法接受局部治疗或根治性治疗的患者。患者按1:1的比例随机分配到接受特瑞普利单抗治疗,第1天240毫克,第1天和第8天1000毫克/平方米吉西他滨,每个21天周期的第1天80毫克/平方米顺铂,最多6个周期,然后接受特瑞普利单抗单药治疗,每3周1次,每次240毫克,作为维持治疗;或安慰剂加相同的吉西他滨/顺铂方案,最多6个周期,然后接受安慰剂维持治疗,每3周1次。治疗最长持续 2 年,或直到疾病进展、出现不可接受的毒性或患者撤回同意为止。
根据RECIST v1.1标准通过盲法独立中央审查(BICR)评估的PFS是该试验的主要终点。次要终点包括客观反应率(ORR)、总生存期(OS)、研究者评估的 PFS、反应持续时间(DOR)和安全性。
其他数据显示,在中位随访39.6个月(1.2-47.4个月)和39.9个月(0.2-48.3个月)时,特瑞普利单抗组未达到中位OS(NR),而安慰剂组为33.7个月(HR,0.63;95% CI,0.45-0.89;双侧P = .008)。
特瑞普利单抗组患者的BICR评估ORR为78.8%,安慰剂组为67.1%,完全应答率分别为26.7%和13.3%。特瑞普利单抗组的中位DOR为18.0个月(95% CI,10.5个月,无法估计),化疗组为6.0个月(95% CI,5.6-8.3个月)(HR,0.49;95% CI,0.33-0.72)。
在安全性方面,两组的任何级别治疗突发不良反应(TEAEs;特瑞普利单抗组,100%;安慰剂组,100%)、3级或更高级别TEAEs(89.7%;90.2%)、致命TEAEs(3.4%;2.8%)、严重AEs(43.8%;43.4%)和输液反应(4.1%;4.2%)发生率相似。特瑞普利单抗方案导致停用特瑞普利单抗或安慰剂(11.6%;4.9%)、免疫相关不良反应(54.1%;21.7%)和3级或以上免疫相关不良反应(9.6%;1.4%)的发生率较高。
JUPITER-06
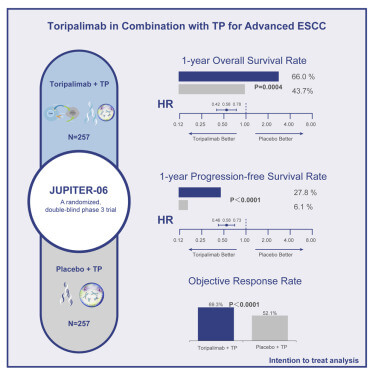
多中心、随机、双盲、安慰剂对照 JUPITER-06 试验招募了局部晚期、复发性或转移性 ESCC 患者,这些患者既往未接受过晚期系统治疗,或在完成围手术期化疗/放疗至少 6 个月后疾病复发。研究结果显示,在中位随访7.1个月时,接受特瑞普利单抗联合化疗的患者(n = 257)的中位PFS为5.7个月(95% CI,5.6-7.0),而接受安慰剂联合化疗的患者(n = 257;HR,0.58;95% CI,0.46-0.74;双侧P < .0001)为5.5个月(95% CI,5.2-5.6)。1年PFS率分别为27.8%(95% CI,20.4%-35.8%)和6.1%(95% CI,2.2%-12.6%)。
特瑞普利单抗治疗组的中位OS为17个月(95% CI,14.0-NR),安慰剂治疗组为11个月(9%% CI,10.4-12.6)(HR,0.58;95% CI,0.43-0.78;双侧P = .0004)。
图源:参考资料[4]
患者年龄需在18至75岁之间,组织学或细胞学确诊为局部晚期、复发性或转移性ESCC。 其他主要入选标准包括:ECOG表现为0或1;预期寿命至少3个月;器官功能正常;根据RECIST v1.1标准至少有一个可测量病灶。
患者按1:1比例随机分配接受特瑞普利单抗或安慰剂联合紫杉醇和顺铂治疗,每3周1次,最多6个周期,然后接受特瑞普利单抗或安慰剂维持治疗。
试验的主要终点是根据 RECIST v1.1 标准进行 BICR 评估的 PFS 和 OS。次要终点包括 ORR、DOR、疾病控制率和安全性。
安全性数据显示,两组患者中均有 99.2% 的患者至少发生过一次任何等级的 TEAE。特瑞普利单抗治疗组发生3级或以上TEAE的比例为73.2%,安慰剂治疗组为70.0%。两组中均有 8.2% 的患者发生致命 TEAE;认为与研究治疗相关的致命 AE 发生率为:特瑞普利单抗治疗组 0.4% 对安慰剂治疗组 1.2%
关于特瑞普利单抗
特瑞普利单抗是我国企业君实生物自主研发的PD-1单克隆抗体,目前在我国获批的适应症有既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗;含铂化疗失败包括新辅助或辅助化疗 12 个月内进展的局部晚期或转移性尿路上皮癌的治疗;既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗;联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗;联合紫杉醇和顺铂适用于不可切除局部晚期/复发或转移性食管鳞癌的一线治疗;联合培美曲塞和铂类适用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗;联合化疗围手术期治疗,继之本品单药作为辅助治疗,用于可切除 IIIAIIIB 期非小细胞肺癌(NSCLC)的成人患者;联合阿昔替尼用于中高危的不可切除或转移性肾细胞癌患者的一线治疗;联合依托泊苷和铂类用于广泛期小细胞肺癌(ES-SCLC)的一线治疗;联合注射用紫杉醇(白蛋白结合型)用于经充分验证的检测评估 PD-L1 阳性(CPS ≥ 1)的复发或转移性三阴性乳腺癌(TNBC)的一线治疗。
【可愈有道】是国内权威的海外医疗咨询服务机构,拥有全球多家知名医院的合作转诊医疗资源。如果您想要快速办理美国/日本/英国等国家出国看病、国际专家远程咨询、日本体检等业务,欢迎拨打免费热线:400-678-6998 进行咨询!
参考文献:
[1] Junshi Biosciences announces positive opinion from the European Medicines Agency’s CHMP for toripalimab. News release. Junshi Biosciences. July 26, 2024. Accessed July 29, 2024.https://www.globenewswire.com/newsrelease/2024/07/26/2919683/0/en/Junshi-Biosciences-Announces-Positive-Opinion-from-the-European-Medicines-Agency-s-CHMP-For-Toripalimab.html
[2] FDA approves toripalimab-tpzi for nasopharyngeal carcinoma. FDA. October 27, 2023. Accessed July 29, 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-toripalimab-tpzi-nasopharyngeal-carcinoma
[3]Mai HQ, Chen QY, Chen D, et al. Toripalimab plus chemotherapy for recurrent or metastatic nasopharyngeal carcinoma: the JUPITER-02 randomized clinical trial. JAMA. 2023;330(20):1961-1970. doi:10.1001/jama.2023.20181
[4]Wang ZX, Cui C, Yao J, et al. Toripalimab plus chemotherapy in treatment-naïve, advanced esophageal squamous cell carcinoma (JUPITER-06): a multi-center phase 3 trial. Cancer Cell. 2022;40(3):277-288.e3. doi:10.1016/j.ccell.2022.02.007


