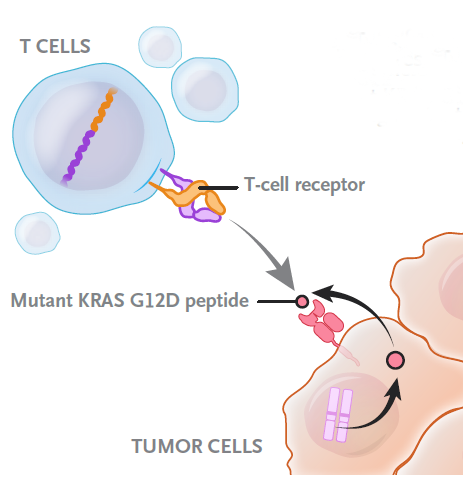
胰腺癌是一种极具侵袭性的恶性肿瘤,早期症状隐匿,确诊时往往已到晚期,导致患者的生存率极低。其发病率逐年上升,且由于诊断难度大和治疗选择有限,胰腺癌被认为是最致命的癌症之一。研究表明,KRAS基因突变在胰腺癌的发生发展中扮演了至关重要的角色。大约90%的胰腺导管腺癌(PDAC)患者携带KRAS基因的突变,尤其是KRAS G12D、G12V等常见突变。这些突变激活了细胞内的MAPK信号通路,导致细胞异常增殖和凋亡,从而促进癌症的进展。 针对KRAS突变的研究正在迅速发展,虽然KRAS长期以来被认为是“不可成药”的靶点,但近年来一些新型疗法已显示出初步的疗效。例如,靶向KRAS G12C的抑制剂在其他类型肿瘤中取得了令人鼓舞的结果,研究者们正在探索类似的策略,试图攻克胰腺癌的KRAS突变。对于胰腺癌患者来说,未来的治疗前景或将因为这些突破性研究而带来新的希望。 胰腺癌关键的突变基因及信号通路 Cells. 2020 Jan 28;9(2):309. doi: 10.3390/cells9020309. 2024年7月31日,美国食品药品监督管理局(FDA)授予新药IMM-1-104,用于一线治疗胰腺导管腺癌(PDAC)患者的快速通道资格。 IMM-1-104是由美国生物医药公司Immuneering Corporation开发的一款新型口服药物。IMM-1-104作用原理是通过抑制MAPK通路,从而实现对RAS基因的广泛抑制。这意味着IMM-1-104可能对多种与RAS基因突变相关的癌症具有治疗作用,尤其在像胰腺癌、肺癌等RAS突变驱动的癌症中,展现了潜在的应用前景。 图源 :摄图网 这项I/IIa期开放标签、多中心的研究评估了新型口服双重MEK1/2抑制剂IMM-1-104在RAS突变的晚期或转移性实体瘤患者中的安全性和抗肿瘤活性。研究共纳入210名患者,分为三组:IMM-1-104单药治疗组(A组)、IMM-1-104联合改良吉西他滨/白蛋白结合型紫杉醇治疗组(B组)、IMM-1-104联合改良FOLFIRINOX治疗组(C组)。招募医院包括丹娜法伯癌症研究院、希望之城、Mayo Clinic和安德森癌症中心。 纳入标准要求参与者年满18岁,并确诊为含有RAS突变(KRAS、NRAS或HRAS)的局部晚期不可切除或转移性实体瘤患者。参与者在单药治疗阶段需接受过至少一线治疗,而联合治疗组的PDAC患者则未接受过针对晚期或转移性疾病的全身抗癌治疗。 该研究的主要终点是根据RECIST v1.1标准评估肿瘤的可测量病变,次要终点包括患者的ECOG体能状态评分为0或1。通过这些指标评估IMM-1-104单药及联合治疗的疗效和安全性,旨在为RAS突变型实体瘤患者寻找新的治疗选择。 美国/日本名医线上会诊 ▼ 研究结果,根据正在进行的1/2a期临床试验(NCT05585320)中的2a期数据,IMM-1-104与改良吉西他滨和白蛋白结合型紫杉醇联合用于一线治疗晚期胰腺癌,显示了积极的疗效。在接受治疗的5名胰腺癌患者中,总缓解率(ORR)为40%,其中1名患者达到完全缓解(CR),另有1名患者部分缓解。疾病控制率(DCR)为80%,这意味着大部分患者病情得到了控制。这5名患者均持续接受每日一次240 mg剂量的IMM-1-104治疗,该剂量被确定为本研究中的安全推荐剂量。 安全性方面,在携带RAS突变的晚期实体瘤患者中,接受IMM-1-104治疗后未出现4级或更高级别的治疗相关不良事件(TRAEs)。仅有1例3级TRAEs为可逆的非严重皮疹,且未报告任何严重不良事件。


图源:摄图网
关于Immuneering公司
Immuneering是美国一家临床阶段的肿瘤公司,致力于开发和商业化针对广泛癌症患者的通用RAS/RAF药物,初步目标是开发通用RAS疗法。公司旨在通过深度循环抑制MAPK通路,实现广泛活性,影响癌细胞的同时保护健康细胞。Immuneering的首要产品候选药物IMM-1-104是一种口服、每日一次的深度循环抑制剂,目前正处于针对携带RAS突变的晚期实体瘤患者的1/2a期临床试验中。IMM-6-415是一种口服、每日两次的深度循环抑制剂,目前正处于针对携带RAS或RAF突变的晚期实体瘤患者的1/2a期临床试验中。
【可愈有道】是国内权威的海外医疗咨询服务机构,拥有全球多家知名医院的合作转诊医疗资源。如果您想要快速办理美国/日本/英国等国家出国看病、国际专家远程咨询、日本体检等业务,欢迎拨打免费热线:400-678-6998 进行咨询!
参考资料:
1、https://ir.immuneering.com/news-releases/news-release-details/immuneering-granted-fda-fast-track-designation-imm-1-104-first
2、Cells. 2020 Jan 28;9(2):309. doi: 10.3390/cells9020309.