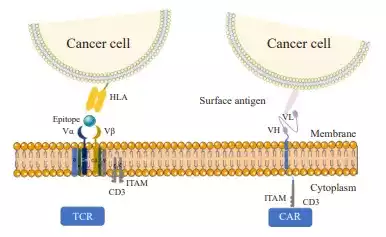
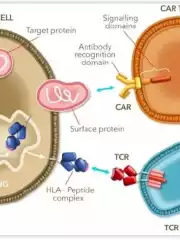
TCR-T疗法是近年来癌症治疗新手段的关注焦点,它能显著提高T细胞对肿瘤抗原的特异性识别能力,精准识别和杀伤肿瘤细胞。 8月1日,美国FDA批准在研工程化T细胞疗法(TCR-T疗法)Tecelra(afami-cel)用以治疗既往接受过化疗的某些HLA类型的晚期MAGE-A4+滑膜肉瘤成人患者。Tecelra(afami-cel)成为10多年来率先获批用于实体瘤的TCR-T疗法,也是滑膜肉瘤的头一个有效选择[1]。 图源:参考文献[1] 滑膜肉瘤是起源于滑膜、滑囊、腱鞘的一种高度恶性肿瘤,手术是治疗滑膜肉瘤的主要选择,但是无法手术的晚期滑膜肉瘤患者,预后效果较差,二线治疗的客观缓解率极低,既往接受过两次或两次以上治疗的滑膜肉瘤患者总体生存期不到 12 个月。 Afami-cel是一种针对MAGE-A4癌症靶点的工程化T细胞受体(TCR)T细胞疗法,被设计作为一种用于晚期滑膜肉瘤的一次性疗法。 批准主要是基于一项关键性研究SPEARHEAD-1中队列1的结果。研究纳入的患者均确诊为晚期转移性滑膜肉瘤,且接受过中位线数为3线的系统性治疗。 研究结果显示,采用TCR-T疗法Afami-cel治疗后,滑膜肉瘤患者的总缓解率为43%,完全缓解率为4.5%,中位缓解持续时间为6个月。在有缓解的患者中,39%患者的缓解持续时间≥12个月。 TCR-T疗法:实体瘤治疗新方向 TCR-T疗法是将肿瘤浸润淋巴细胞的TCR基序或该TCR的编码基因,通过载体导入成熟T细胞,并在体外扩增与激活,过继回输实现肿瘤治疗[2]。 与CAR-T疗法相比,TCR-T疗法能够识别更多的靶抗原和肿瘤类型;而且TCR-T通过基因工程改造,对肿瘤细胞的亲和力增强,可被微量靶抗原激活,因此,比CAR对低浓度的靶抗原更敏感。由于实体瘤细胞缺乏细胞表面生物特异性标志物,因此TCR-T比CAR-T更适宜于实体瘤的治疗。 总而言之,TCR-T 疗法凭借①细胞内外肿瘤特异性抗原都可识别、②靶向实体瘤效果更明显、③体内存留时间更长等优势,已经成为新一代抗肿瘤利器。 TCR和CAR与肿瘤细胞的识别及作用模式,图源:参考文献[3] Afami-cel的获批是TCR-T疗法的重要里程碑。目前临床上仍有多款处于1/2期阶段及以上的在研TCR-T疗法靶向不同种类的靶点与癌症种类。 2023年,T细胞受体T细胞(TCR-T)疗法IMA203单药治疗复发和/或难治性实体瘤患者的1b剂量扩展试验数据披露,TCR-T疗法治疗包括皮肤黑色素瘤、铂耐药卵巢癌、葡萄膜黑色素瘤、头颈癌和滑膜肉瘤等实体瘤的客观缓解率为67%,最高的持续缓解时间超过9个月[4]。 2022年欧洲肿瘤内科学会(ESMO)大会中公布了TCR-T疗法ADP-A2M4CD8治疗实体瘤的1期临床试验结果,数据显示,在所有的癌症类型的43名患者中,采用单剂ADP-A2M4CD8治疗的客观缓解率为33%,疾病控制率为81%[5]。 总而言之,TCR-T疗法在治疗实体瘤方面显示出前所未有的前景,成为极具潜力的治疗方式。相信在未来,TCR-T疗法将会为更多实体瘤患者带来良好的预后,成为实体瘤治疗的“利器”! 可愈有道通过专业的医学服务团队和广泛的国际医疗资源,帮助患者在全球范围内寻找优质权威的抗癌治疗,真正实现健康的全球化管理,不仅可以让患者更安心地进行治疗,也能保证患者及时获得有效的治疗方案,实现更好的预后,提高生存率和生活质量。如需要了解更实体瘤治疗相关内容,或有意向咨询世界权威专家进行诊治,可通过热线400-678-6998直接联系小愈进行咨询。 参考文献: [1]Adaptimmune Receives U.S. FDA Accelerated Approval of TECELRA® (afamitresgene autoleucel), the First Approved Engineered Cell Therapy for a Solid Tumor :: Adaptimmune (ADAP) https://www.adaptimmune.com/investors-and-media/news-center/press-releases/detail/271/adaptimmune-receives-u-s-fda-accelerated-approval-of [2]Ye B, Stary CM, Gao Q, Wang Q, Zeng Z, Jian Z, Gu L, Xiong X. Genetically Modified T-Cell-Based Adoptive Immunotherapy in Hematological Malignancies. J Immunol Res. 2017;2017:5210459. doi: 10.1155/2017/5210459. Epub 2017 Jan 2. PMID: 28116322; PMCID: PMC5237740. [3]TCR-T免疫治疗肿瘤:现状、挑战及展望 http://www.china-oncology.com/fileup/1007-3639/PDF/1691647734535-26153295.pdf [4]Immatics Reports Interim Clinical Data from Ongoing Phase 1b Cohort A Monotherapy with ACTengine® IMA203 TCR-T Targeting PRAME | Immatics N.V. https://investors.immatics.com/news-releases/news-release-details/immatics-reports-interim-clinical-data-ongoing-phase-1b-cohort [5]Adaptimmune Reports Positive Data in its SURPASS Trial; Outlines Plans for Advanced Clinical Development in Multiple MAGE-A4 Positive Solid Tumors :: Adaptimmune Therapeutics plc (ADAP) https://www.adaptimmune.com/investors-and-media/news-center/press-releases/detail/231/adaptimmune-reports-positive-data-in-its-surpass-trial