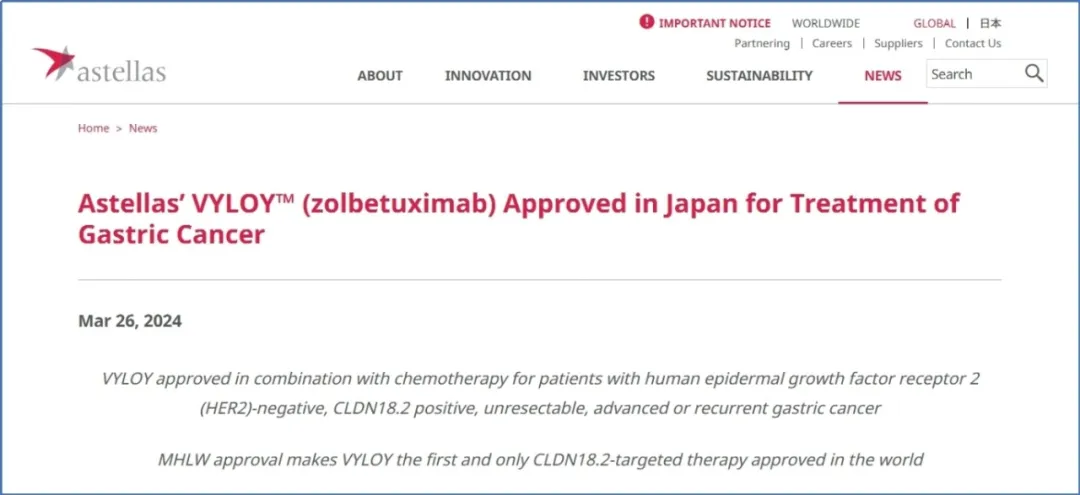
2024年3月26日,日本厚生劳动省(MHLW)批准了一种名为zolbetuximab(佐贝妥昔单抗,代号IMAB362)的CLDN18.2单克隆抗体,用于治疗人表皮生长因子受体2(HER2)阴性、CLDN18.2阳性、不可切除、晚期或复发性胃癌患者。Zolbetuximab成为世界监管机构批准的第一个、也是唯一一个CLDN18.2靶向疗法。
这款药物的正式上市对于晚期胃癌患者来说是一个重大的里程碑。它为这些患者带来了新的治疗选择和生存希望,有望显著改善他们的生活质量。随着这种药物的问世,患者和医生将有更多的工具和资源来应对这种艰难的疾病。
胃癌是全球常见的一种癌症,也是造成许多癌症死亡的原因之一。由于早期症状与其他许多常见胃部疾病相似,胃癌往往在晚期或转移时才被发现。晚期胃癌患者的5年生存率仅为6.6%,迫切需要有效的治疗选择。因此,开发新的靶向疗法对于晚期胃腺癌等疾病至关重要。日本国立癌症中心东院胃肠肿瘤科主任 Kohei Shitara 博士说:“作为3期SPOTLIGHT临床试验的主要研究者,我亲眼见证了接受[zolbetuximab]联合化疗治疗的患者的PFS和总生存期[OS]明显改善,与接受安慰剂加化疗的患者相比。这些结果支持zolbetuximab作为日本CLDN18.2阳性人群的新治疗选择。CLDN18.2阳性群体的广泛分布为其在临床应用中奠定了基础。FAST试验和MONO试验分别显示,白人群体中有48%和45%的患者CLDN18.2阳性,其中36%和24%的患者表达水平高。在日本的一项研究中,52%(135/262)的原发性肿瘤呈阳性(按照FAST的标准),这支持了在亚洲人中使用zolbetuximab的治疗评估。进一步的研究表明,在美国样本中高CLDN18.2的比例为34%,在亚洲样本中为24%。zolbetuximab联合化疗治疗的安全性良好可控在SPOTLIGHT研究中,zolbetuximab组中常见的任何级别的治疗相关不良反应(TEAE)包括恶心(82%)、呕吐(67%)和食欲下降(47%)。在GLOW研究中,研究组中常见的任何级别的TEAE包括恶心(68.5%)、呕吐(66.1%)和食欲下降(41.3%)。
Zolbetuximab是一种抗CLDN18.2(claudin 18.2)单克隆抗体,已经获得日本厚生劳动省(MHLW)批准,用于治疗CLDN18.2阳性、不可切除的晚期或复发性胃癌患者。Zolbetuximab与化疗联合用于HER2阴性肿瘤的患者。Zolbetuximab是世界上第一个,也是唯一一个获得监管机构批准的CLDN18.2靶向疗法。CLDN18.2阳性应由具有足够经验的病理学家或实验室使用经批准的体外诊断试剂或医疗设备进行确认。作为针对人类CLDN18.2的抗体,VYLOY结合到胃癌等癌细胞的细胞膜上表达的CLDN18.2,并展现出抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC),从而抑制肿瘤生长。Zolbetuximab的获批意味着胃癌治疗进入了一个新时代,为CLDN18.2阳性患者提供了全球头一款靶向治疗药物。这款药物的获批对于全球晚期胃癌患者是一项重大利好。随着日本市场的开启,欧美和中国等地区的审批进程可能也将加速。这意味着,更多的患者将能够获得这一创新治疗,增加了他们对于战胜疾病的希望。同时,这也为医疗领域带来了新的治疗选择,有望在全球范围内提高晚期胃癌患者的生存率和生活质量。
随着这一药物的逐步批准和上市,我们也看到了全球药物审批过程的不断优化和加速。各国药品监管机构之间的合作和信息共享,以及对于创新药物的优先审批政策,都为患者及时获得最新治疗提供了有力支持。这也反映了全球医疗界对于晚期胃癌等疾病的关注和应对态度,希望通过不断创新和合作,为患者带来更多更好的治疗选择。
参考资料:
1. https://www.astellas.com/en/news/29026
2.Shitara K, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. The Lancet. Published online April 14, 2023; S0140-6736(23)00620-7.