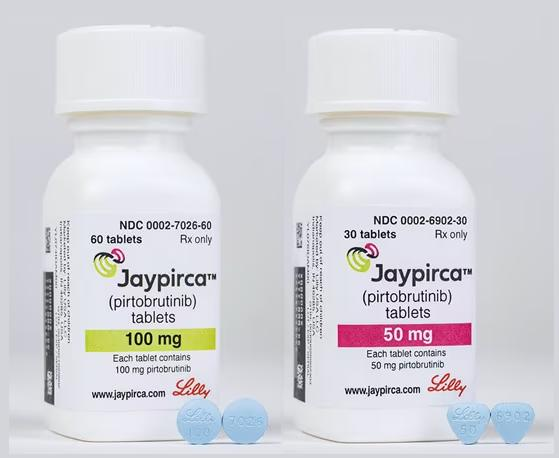
12月1日,礼来公司宣布,美国食品和药物管理局(FDA)批准Jaypirca(pirtobrutinib)100mg和50mg片剂,用于治疗成年患有慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(CLL/SLL)的患者,这些患者之前接受过至少两种治疗,包括BTK抑制剂和BCL-2抑制剂。在BRUIN 1/2期试验中,Jaypirca的疗效评估基于108名接受治疗的CLL/SLL患者的数据。
摄图网
根据试验结果,Jaypirca每日200mg的剂量被持续使用,直到疾病进展或出现不可接受的毒性。疗效评估基于患者的整体反应率(ORR)和持续反应持续时间(DOR),根据2018年慢性淋巴细胞白血病国际研讨会(iwCLL)的标准进行评估。
在安全性方面,Jaypirca的汇总安全性分析包括593名患有血液恶性肿瘤的患者。在这个患者群中,Jaypirca治疗的最常见不良反应发生在20%或更多的患者中,包括实验室异常、疲劳、肌肉骨骼疼痛、腹泻、瘀伤和咳嗽等。
在针对CLL/SLL患者的安全性评估中,110名患者接受了Jaypirca治疗,其中98%的患者之前接受过至少两种全身治疗,包括BTK抑制剂和BCL-2抑制剂。在这些患者中,60%的患者接受了Jaypirca治疗至少一年,14%的患者接受了至少两年的治疗。不良反应导致了3.6%的患者剂量减少,42%的患者中断治疗,9%的患者永久停用Jaypirca。
总体而言,Jaypirca是第一个也是唯一一个经FDA批准的非共价BTK抑制剂,它在先前接受过BTK抑制剂治疗的CLL/SLL患者中展现出了扩大靶向BTK通路益处的潜力。它利用了一种新颖的结合机制,并在之前接受过BTK抑制剂治疗的患者中具有最多的临床证据。 可愈有道努力推动国际医学合作,为更多需要帮助的患者朋友们带来健康和希望,我们与海外多家知名医院保持着紧密的合作关系,如果您需要咨询或寻求专业意见,可以致电我们的客服热线:400-678-6998,或扫描二维码联系我们。 免责声明:公司所提供的信息均来源于网络上公开发表的文献或文章,仅供用户参考使用。本公司力求为用户提供准确、客观的信息资料与数据,用户据信息作出的选择和判断,公司不承担任何经济与法律责任。