长期以来,遗传性视网膜疾病(IRDs)一直被视为基因治疗的理想领域,因为大多数导致这些疾病的基因突变已经得到确认,并且眼睛在一定程度上被认为是一个免疫特权区域。此外,临床试验表明,在眼部应用腺相关病毒(AAV)或慢病毒(LV)作为载体来传递基因疗法不会引发全身性副作用,并且不会引起明显的免疫反应。
01
LUXTURNA作为日本首款眼疾基因治疗药纳入医保
02
LUXTURNA于2017年12 月19日获FDA 批准上市
03
LUXTURNA于2018年11 月1日入围国家药审中心发布的《第一批临床急需境外新药名单》
04
LUXTURNA于2020年10月18日登陆加拿大

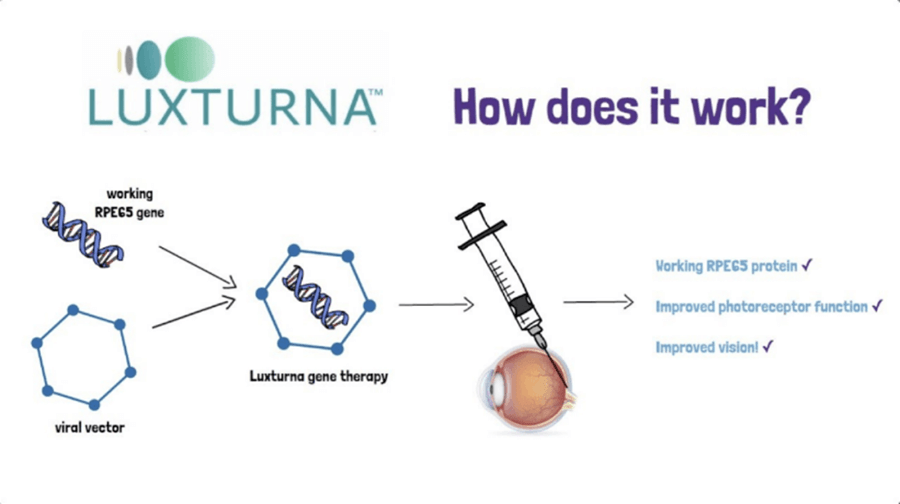
LUXTURNA的获批作为公费医疗保险的适用对象,象征着在日本基因治疗药物领域在日本迈向了一个重要的里程碑。随着科技的不断进步,基因治疗正逐渐崭露头角,成为解决罕见疾病和遗传性疾病的有效手段。可以预见,未来随着更多基因治疗药物的研发和批准,患有这些疾病的患者将能够获得更加有效的治疗,恢复健康和寻找到新的希望。
参考资料:
1、https://t.qianzhan.com/caijing/detail/230823-53b8f921.html
2、https://www.sohu.com/a/715794093_121218821
免责声明:公司所提供的信息均来源于网络上公开发表的文献或文章,仅供用户参考使用。本公司力求为用户提供准确、客观的信息资料与数据,用户据信息作出的选择和判断,公司不承担任何经济与法律责任。
