2023年,中国医药领域迎来了令人振奋的里程碑时刻,共有8种创新抗癌疗法成功上市。这一系列新药的问世标志着中国在癌症治疗领域取得了重大进展,为数以千计的晚期患者提供了新的治疗选择。这些创新疗法涵盖了多种癌症类型,为患者带来了更加个性化和有效的治疗方案。随着这些药物的上市,中国的抗癌药物研发水平再次得到肯定,为全球医学科研和患者的福祉贡献着积极力量。
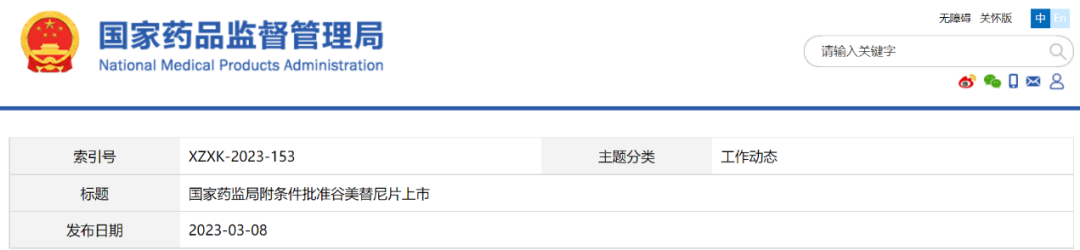
谷美替尼片(SCC244)
批准日期:2023年3月8日
突破性治疗:附条件批准上海海和药物研究开发股份有限公司的谷美替尼片,为MET外显子14跳变的晚期非小细胞肺癌提供创新疗法。
伯瑞替尼肠溶胶囊
批准日期:2023年11月16日
治疗选择扩展:附条件批准上市,伯瑞替尼成为治疗MET外显子14跳变非小细胞肺癌的新选择,标志着对患者的治疗范围的进一步拓展。

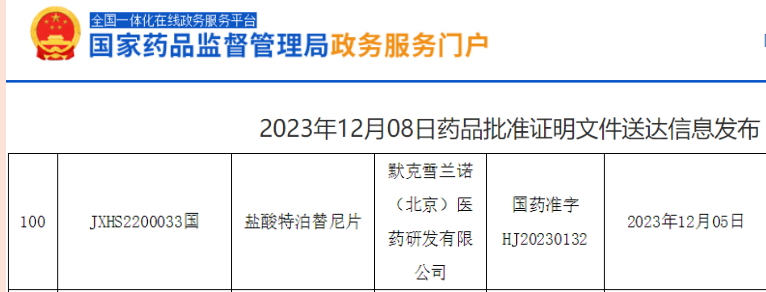
特普替尼(Tepmetko)
批准日期:2023年12月8日
全球首款:盐酸特泊替尼片全球首款上市,成功扩大METex14跳跃非小细胞肺癌患者的治疗选择。
斯鲁利单抗(H药,serplulimab,HLX10)
批准日期:2023年1月17日

艾瑞卡(卡瑞利珠单抗)
批准日期:2023年1月31日
突破:恒瑞医药成功获批肝癌一线治疗的新适应症,艾瑞卡与艾坦(阿帕替尼)“双艾”组合为晚期肝细胞癌患者提供全新疗法,标志着中国首个PD-1抑制剂与小分子抗血管生成药物组合的批准。
优赫得(德喜曲妥珠单抗)
批准日期:2023年2月24日
首次批准:DS8201成功获批中国市场,成为全球首个ADC型药物在华上市,为不可切除或转移性HER2阳性成人乳腺癌患者带来新曙光。

福可苏®(伊基奥仑赛注射液)
批准日期:2023年6月30日
全球首创:驯鹿生物和信达生物联合研发的BCMA CAR-T疗法成功获批,这不仅是中国首款,也是全球首个全人源靶向BCMA的CAR-T疗法,为复发或难治性多发性骨髓瘤患者带来全新治疗方案。
源瑞达®(纳基奥仑赛注射液)
批准日期:2023年11月8日
里程碑:合源生物宣布其CAR-T产品源瑞达®(纳基奥仑赛注射液)正式获批上市,成为中国白血病治疗领域首款CAR-T疗法,成功通过临床研究,为成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)患者带来新的治疗机会。
英飞凡®(度伐利尤单抗)
批准日期:2023年11月7日
一线免疫治疗:基于全球Ⅲ期研究TOPAZ-1的三阳结果,度伐利尤单抗成功获批新适应症,联合吉西他滨和顺铂用于局部晚期或转移性胆道癌(BTC)成人患者的一线治疗,为改善BTC患者生存的免疫联合方案在中国临床的应用打开了新的篇章。
高罗华(Columvi,中英文通用名:格菲妥单抗/glofitamab)
批准日期:2023年11月
2023年11月,中国国家药品监督管理局(NMPA)批准高罗华用于治疗成年患者复发或难治性弥漫性大B细胞淋巴瘤(R/R DLBCL),这是全球首个获批的双特异性抗体。格菲妥单抗为曾接受至少两线系统性治疗的患者提供了固定周期治疗选择,标志着中国淋巴瘤治疗进入全新的双抗治疗时代。
可愈有道努力推动国际医学合作,为更多需要帮助的患者朋友们带来健康和希望,我们与海外多家知名医院保持着紧密的合作关系,如果您需要咨询或寻求专业意见,可以致电我们的客服热线:400-678-6998,或扫描二维码联系我们。
参考资料:中国NMPA官网
免责声明:公司所提供的信息均来源于网络上公开发表的文献或文章,仅供用户参考使用。本公司力求为用户提供准确、客观的信息资料与数据,用户据信息作出的选择和判断,公司不承担任何经济与法律责任。