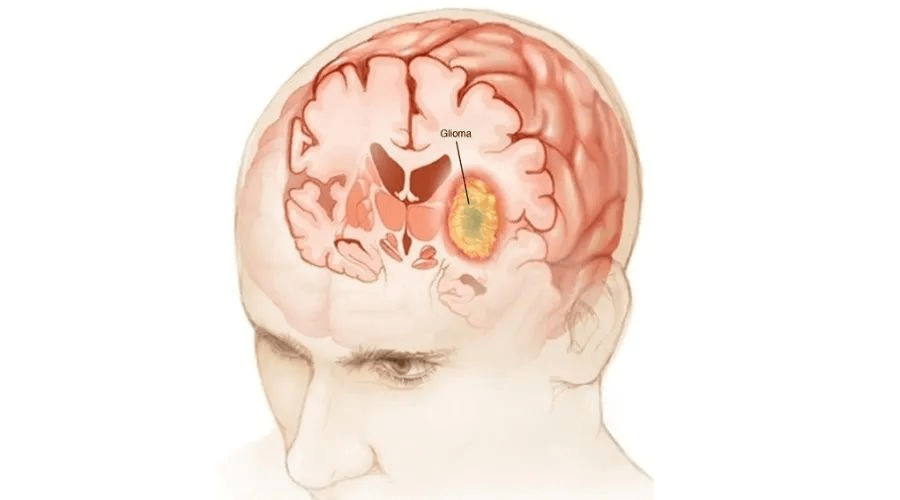
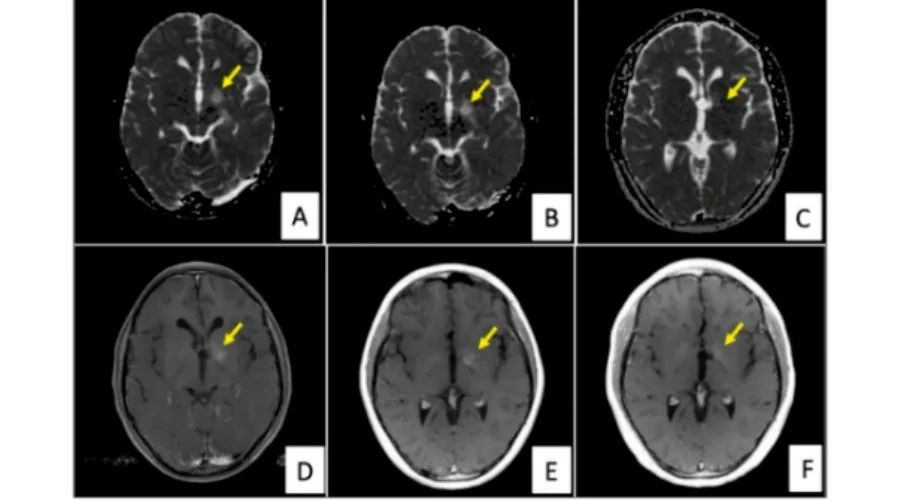
胶质瘤(Glioma)是一类起源于中枢神经系统胶质细胞的肿瘤。根据组织学病理学,胶质瘤被分为星形细胞瘤、少突胶质细胞瘤、少突-星形细胞瘤和脑室管膜瘤。 根据恶性程度,世界健康卫生组织(WorldHealthOrganisation,WHO)将胶质瘤进一步细分为Ⅰ~Ⅳ级。 ·Ⅰ级包含几个亚型,如毛细胞型星形胶质瘤、室管膜下瘤、胶质神经元肿瘤,基本属于良性的范畴,常以青年人居多,切除之后病变基本能控制,偶有并发症及复发; ·Ⅱ级以上根据不同的基因检测分成不同的类型,术后控制在5-7年; ·Ⅲ级为间变性胶质瘤,需要结合放化疗的治疗; ·Ⅳ级为胶质母细胞瘤,恶性度高,生存期约2年左右。 小脑是儿童胶质瘤最为常见的发生部位,其次是脑干、视神经通路和下丘脑等。就胶质瘤而言,儿童胶质瘤中毛细胞型星形细胞瘤最常见,与恶性胶质瘤和室管膜瘤等中枢系统肿瘤类似,其发生率随着年龄的增加略有下降。髓母细胞瘤等也常发生于儿童,高级别胶质瘤仅为儿童中枢神经系统肿瘤的10%~15%。 儿童胶质瘤患者的5年生存率明显高于成人胶质瘤患者。儿童毛细胞型星形胶质瘤和弥散型星形胶质瘤患者的5年生存率分别为97.1%和82.5%。儿童胶质母细胞瘤患者的5年生存率可达20.8%。 此外,在组织病理学方面,儿童低级别胶质瘤所呈现的病理表现与成人相似,但是儿童低级别胶质瘤较少发生从低级别胶质瘤恶性转化为高级别胶质瘤。 如何分类? 胶质瘤是儿童和青少年最常见的中枢神经系统肿瘤,其中: 低级别胶质瘤(low-grade gliomas,LGGs)占儿童中枢神经系统肿瘤的25%~30%,尤以毛细胞型星形细胞瘤最为多见。LGGs患者的预后通常良好,其5年总生存率约为95%。 高级别胶质瘤(high-grade gliomas,HGGs)发生率相对较低,约为低级别胶质瘤的50%,主要包括间变型星形细胞瘤和胶质母细胞瘤。 致病因素有哪些? 电离辐射 大剂量电离辐射是导致儿童胶质瘤的一种原因。 遗传性因素 部分儿童胶质瘤与遗传性因素有关,但并非每个家庭都具备。 恶性肿瘤常见的致病因素 包括亚硝酸盐食物、病毒或者细菌感染。 临床表现有哪些? 大多数儿童胶质瘤表现为良性、生长缓慢的病变。 头部肿块 儿童胶质瘤的临床表现最常见的是头部肿块,一般呈现为较为规则的圆形肿块,肿块较小时容易被忽视,肿块较大时会可见到肿块表面的血管曲纹。 体表脉管增多 儿童胶质瘤表面伴有脉管增多,如皮肤弹性较差,表面脉管突出,血管结构发育不良,脉管有时会破裂。 颅内压力增加 儿童胶质瘤的肿瘤体积增大时,会增加颅内压力,从而导致儿童头痛、头晕、眼球突出、视力减退、精神倦怠、视物模糊等症状。 如何做出诊断? 体格检查 进行体格检查时,可发现儿童低级别胶质瘤(Pediatric low-grade gliomas,PLGGs)患儿存在前囟膨隆、双眼向上注视减少、第六节脑神经麻痹和视乳头水肿等体征。导致此类体征的PLGGs主要位于小脑、视交叉/下丘脑、脑干背外侧(从第四脑室底部生长到脑室)和顶盖区(可阻塞脑导水管)。PLGGs可发生在中枢神经轴的任何地方,最常发生于小脑。 影像学检查 头颅CT和/或头颅MRI(平扫、增强)是目前最主要的检查方法。 这两种成像方法可以相对清晰精确地显示脑解剖结构特征和脑肿瘤病变形态学特征,如部位、大小、周边水肿状态、病变区域内组织均匀性、占位效应、血-脑脊液屏障破坏程度及病变造成的其他合并征象等。 观察 病灶的生长部位 病灶是否为实性、囊性或囊实性 病灶是单发或多发 病灶是否存在钙化、出血及血供情况 是否合并其他疾病或畸形 实验室检查 一般常规检查:血常规、凝血常规、肝肾功能、尿常规、心电图、正位胸片,以及血清电解质Na+、K+、Cl-。 内分泌指标检测:总三碘甲状腺原氨酸、总甲状腺素、游离三碘甲状腺原氨酸、游离甲状腺素、促肾上腺皮质激素、促卵泡素、黄体生成素、皮质醇、睾酮、人生长激素,如果内分泌指标异常需排除肾上腺疾病。 脑脊液检查:在无禁忌情况下,腰椎穿刺送检脑脊液,脑脊液常规、生化、癌细胞检查,明确是否存在脑脊液播散转移。 眼科检查:完善视力、视敏度、视野、眼底、瞳孔测试、眼球运动等眼科检查,评估视觉功能受损情况。 肿瘤标志物:甲胎蛋白、癌胚抗原、人绒毛膜促性腺激素β;脑脊液肿瘤脱落细胞检测。 筛查患儿肿瘤相关性分子标志物(根据当地医院具体情况可选择)。 传统治疗方法有哪些? 儿童胶质瘤和成人胶质瘤在组织学上表现相似,但是对于儿童胶质瘤的治疗方案主要来源于成人胶质瘤,当前对于两种胶质瘤的治疗方案并无明显区别。 手术治疗 手术治疗是大部分胶质瘤患者治疗的第一步,就算无法完全切除肿瘤,也可以显著改善患者的症状。 手术治疗的难点主要有两点,一是对胶质瘤边界的识别,很多弥漫性的脑胶质瘤边界模糊无法与正常组织区分开来,导致很多经验还不够丰富的医生选择更加保守的治疗方式;二是胶质瘤侵占到了大脑功能区,手术风险会更高。大脑支配控制着人体的各项功能,例如感觉运动区、语言区、认知功能区等,如果切除不当,会使患者出现偏瘫、失明、失语等后遗症。 手术的适应证和禁忌证 (1)适应证 影像学检查提示颅内占位 存在明显的颅内高压征象 存在由于肿瘤占位而引起的神经功能障碍 有明确癫痫发作史 患儿及其家属自愿接受手术 (2)禁忌证 严重心、肺、肝、肾功能障碍,一般状况差不能耐受手术者 其他不适合接受神经外科开颅手术的禁忌证 目前,儿童低级别胶质瘤(PLGGs)的主要疗法是在安全的情况下对患儿的病灶进行最大范围的手术切除,并在术后对其进行密切监测。病灶的切除程度是影响患儿无进展生存期(progression free survival,PFS)和总生存期(overall survival,OS)最关键的因素。 因此,PLGGs的治疗决策可分为以下3组: 经手术完全切除患儿的肿瘤。 仅对患儿进行肿瘤次全切除术。 不对患儿进行手术(仅对其进行组织活检),根据其病情对其进行非手术治疗。不能接受手术的患儿通常是病灶累及深中线幕上区、视神经通路/下丘脑或脑干的患儿。位于小脑和大脑浅表的PLGGs最适合进行手术切除。 化疗 肿瘤切除程度影响化疗效果。推荐化疗应在最大范围安全切除肿瘤的前提下进行。术后应尽早开始化疗。在保证安全的前提下,采用最大耐受剂量的化疗和合理的化疗疗程,应注意药物毒性。根据组织病理和分子病理结果,选择合适的化疗方案。 无法全切除的儿童低级别胶质瘤存在进展和复发可能,通常予长春新碱联合卡铂或单药化疗,长春新碱联合卡铂化疗可显著延长<10岁的进展期胶质瘤患儿5年无进展生存期(PFS);长春新碱单药化疗(1次/周)亦可显著延长进展期胶质瘤患儿的无进展生存期和总生存期(Os)。 应注意的是,替莫唑胺方案作为成人胶质瘤的标准治疗并不适用于儿童低级别胶质瘤,总体响应率较低,无法获得有效的治疗反应。 放疗 进行放疗前需要放射肿瘤学专家对患儿进行完整的评估,包括病史和体检,特别是神经系统的症状和体征,并结合外科手术、病理报告和影像学诊断等内容。这些都决定了辐射技术剂量的选择。特别是病理诊断的明确至关重要,一般情况下,至少需要通过活检以最小的创伤获得组织病理的诊断,从而使误诊的风险最小化。 目前对于低级别胶质瘤(LGGs),放疗主要是应用于不能手术切除(或不能二次手术切除)肿瘤及化疗后肿瘤快速进展的患儿。 高级别胶质瘤(HGGs)生存时间与放疗开始时间密切相关,术后早期放疗能有效延长HGG患儿的生存期,强烈推荐术后尽早(术后2~6周)开始放疗。常规认为可以开始放疗的年龄为3岁,但对于HGGs患儿,应适当放宽年龄限制。 儿童低级别胶质瘤(PLGGs)患儿的肿瘤若位于小脑幕上中线区域,通常不适合直接进行手术切除治疗。对于这类患儿,若其无明显的临床症状,可暂时对其进行随访和定期神经影像学检查。当其病情进展时,可对其进行辅助治疗(化疗+放疗)。 对于年龄大于5岁的此类患儿,建议进行放射治疗。进行局灶性放疗的范围应达到肿瘤病灶周边1~2cm。对颅内肿瘤和年龄大于5岁的患儿进行放疗时辐射剂量应为54Gy,对脊髓肿瘤和年龄小于5岁的颅内肿瘤患儿进行放疗时辐射剂量应为50Gy。 质子治疗脑胶质瘤的特点 质子治疗是一种新兴的放疗技术,具有独特的物理特性,可以精准靶向肿瘤细胞,减少对周围正常组织的放疗剂量,减少因放疗带来的毒副作用,已经成为胶质瘤放疗最重要的手段。 胶质瘤质子治疗是指通过氢原子在回旋加速器内或者同步加速器内进行高能加速,从而成为具有很强穿透力的质子射线,再利用这些质子射线瞄准胶质瘤所在的部位,对胶质瘤进行照射,可靶向肿瘤细胞,从而造成胶质瘤细胞的不可逆性损伤,使胶质瘤细胞发生死亡,这样能够达到治疗胶质瘤的目的。 质子治疗儿童胶质瘤的优势 1.降低继发癌症的可能性。 常规放射治疗具有人体浅表部位剂量大、穿透人体、照射区域广的特点,因此其对健康组织的辐射也是一种致癌物。有资料显示,传统放疗(X线)对儿童肿瘤有25%的放射导致继发性肿瘤的风险,肿瘤外质子释放的辐射源减少,继发性癌症的可能性降低,这对儿童非常重要。 2.对肿瘤周围组织损伤小,不影响生长发育。 随着儿童癌症治疗的进展,儿童存活率提高,存活儿童的生活质量越来越受到关注。质子治疗具有减少散射剂量和提高肿瘤局部控制的优点。同时,由于大脑中有很多神经组织,容易受到辐射损伤。由于质子治疗具有布拉格峰的物理特性,峰位对准肿瘤病灶,发射高剂量,产生高峰值,达到非常好的肿瘤杀伤效果。峰值剂量趋于零,对周围脑组织影响不大。对于儿童脑肿瘤,可以避免常规化疗带来的听力下降、认知功能障碍、智力影响。 3.质子治疗后不可切除或术后残留的低级别胶质瘤的8年无进展生存率(PFS)为82.8%。与传统放疗相比,质子治疗可以保留脑胶质瘤患儿的阅读能力,减少严重的毒副作用。 质子治疗对儿童胶质瘤的治疗效果 对于质子治疗胶质瘤的效果,有报道显示采用质子治疗星形细胞瘤Ⅱ-Ⅲ级20例,实际5年生存率全组病例为40%,其中星形细胞瘤Ⅱ级为71%,星形细胞瘤Ⅲ级为23%。有4例Ⅱ级病例存活时间超过61个月。 根据美国癌症协会2015年的一份研究,对胶质瘤患者进行质子治疗,在治疗后没有患者出现明显副作用,大多数患者的智力功能没有受到任何影响,空间认知、注意力、记忆力和执行功能,也都在良好的范围之内。 反映了质子治疗胶质瘤可明显提高局控率和延长生存期,其预后明显的相关因素是肿瘤的分化程度。 (质子治疗前(A)、质子治疗10个月(B)和质子治疗25个月(C)对比,图源:文献) 图文参考来源: 【1】许鹏飞,杨吉安,杨雪,等. 儿童胶质瘤与成人胶质瘤的研究进展[J]. 医学研究杂志,2019,48(2):5-7,11. 【2】石易鑫,马文斌,王裕. 基于美国SEER数据库的儿童胶质瘤临床特点和预后分析[J]. 中国现代神经疾病杂志,2021,21(3):147-155. 【3】朱涛,李禄生. 儿童低级别胶质瘤诊断及治疗的研究进展[J]. 当代医药论丛,2021,19(12):23-26. 【4】中华人民共和国国家卫生健康委员会. 儿童脑胶质瘤诊疗规范(2021年版)[J]. 肿瘤综合治疗电子杂志,2021,7(3):22-31.