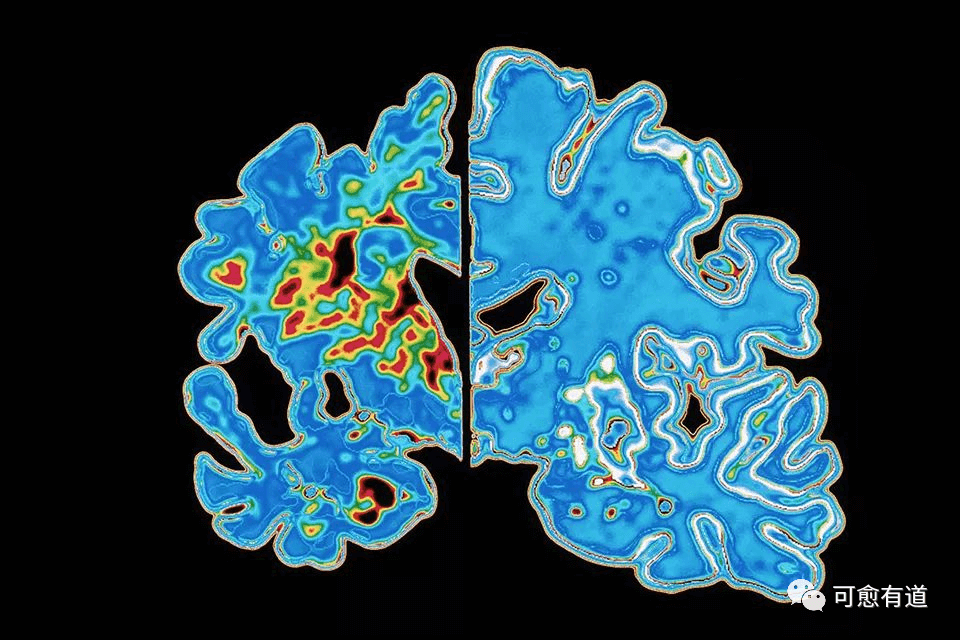
▲由于大量神经元死亡,与正常人的大脑(右)相比,阿尔茨海默病病人的大脑(左)会出现严重的萎缩。
目前,全球至少有5000万痴呆患者,预计到2050年,将达1.52亿,其中约60%-70%为阿尔茨海默病患者。
AD是当前医疗需求中最重要且增长最迅速的未满足需求之一,迄今为止还没有任何药物能够逆转或减缓该疾病的进展速度。人类和动物的基因研究表明,β淀粉样蛋白的合成与阿尔茨海默病直接相关,但基因研究并不能准确预测蛋白质在机体中的行为。虽然我们了解到这种蛋白质的存在与疾病的发展密切相关,但我们仍然需要进一步研究来揭示其具体作用机制以及如何干预蛋白质的异常积聚。

7月6日,经过美国食品和药物管理局在验证性试验中确认其具有临床益处后,Leqembi(lecanemab-irmb)将被批准用于治疗成年阿尔茨海默病患者,并转变为传统批准状态。Leqembi是一种针对β淀粉样蛋白的抗体药物,它是首个从加速批准转为传统批准的治疗阿尔茨海默病的药物。该药物的作用是减少在大脑中形成的淀粉样斑块,这是该疾病的特征性病理生理变化。

Lecanemab显著降低CDR-SB评分的增加速度

▲Lecanemab显著改善多个次要终点指标
Leqembi的最常见副作用是头痛、输注相关反应和与靶向淀粉样物质的抗体类药物相关的影像异常(ARIA)。ARIA是一种已知在靶向淀粉样物质的抗体类药物中出现的副作用。ARIA最常见的表现是脑部某些区域的暂时性肿胀,可以在影像学研究中观察到,通常会随时间而消退,同时可能伴有脑内或脑表面的小出血点。尽管ARIA通常不伴随任何症状,但有时会出现头痛、困惑、头晕、视力变化和恶心等症状。ARIA也可能很少见地导致严重和危及生命的脑水肿,可能伴随癫痫和其他严重的神经系统症状。接受此类药物治疗的患者可能出现颅内出血,并且可能具有致命性。处方信息中包含了一个警告框,以提醒患者和护理人员注意与ARIA相关的潜在风险。
参考资料:
https://www.fda.gov/news-events/press-announcements/fda-converts-novel-alzheimers-disease-treatment-traditional-approval
END
“可愈有道”可以为您提供:美国看病、日本看病、欧洲看病、国际专家会诊、出国体检、质子重离子治疗等服务。拥有中国、日本和美国等多国专业医疗服务团队,包括:医学咨询医生、英语/日语医学翻译、健康管理师、医疗签证办理、就医行程安排等。