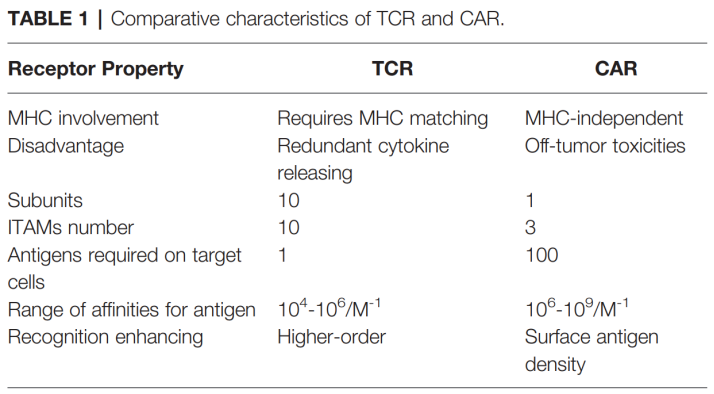
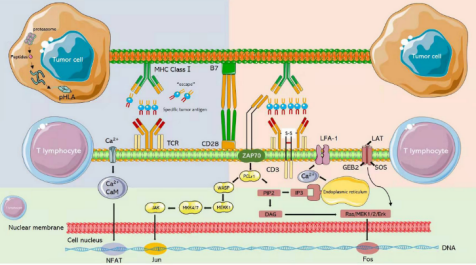
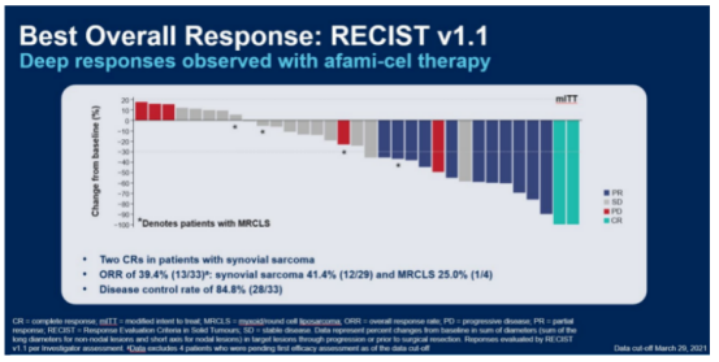
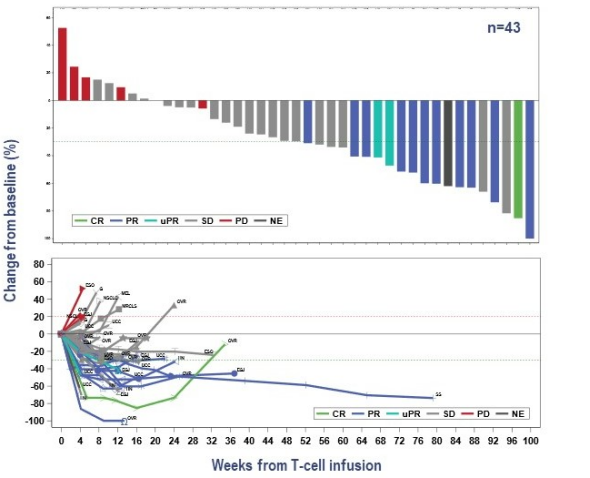
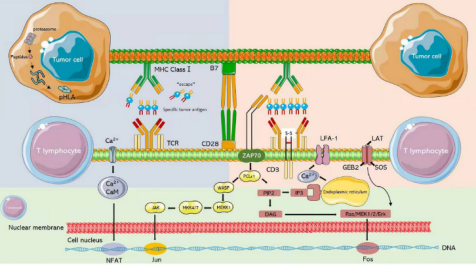
2013年,肿瘤免疫法被《科学》杂志评为年度十大科技突破之首,其中嵌合抗原受体( chimeric antigen receptor,CAR) -T 和 T细胞受体( T cell receptor,TCR) -T 细胞治疗是目前最受关注的疗法。由于TCR-T细胞识别具有高度简并性,可识别的抗原库更大;以及近年来测序技术、质谱技术和生物信息学技术的快速发展,体外鉴定肿瘤抗原肽及特异性TCR的手段日趋完善,因此TCR-T疗法极具实体瘤治疗优势。目前,TCR-T 疗法凭借①细胞内外肿瘤特异性抗原都可识别、②靶向实体瘤效果更明显、③体内存留时间更长等特点,已经成为继CAR-T细胞治疗后新一代抗肿瘤利器。 TCR-T 细胞疗法是筛选和鉴定能够特异性结合选择靶点抗原的TCR 序列,通过基因工程手段将其转入到患者外周血来源的 T 细胞中( 或异源T细胞) ,再将改造后的 T 细胞回输至患者体内,使其特异性识别和杀伤表达抗原的肿瘤细胞,从而达到治疗肿瘤的目的。 根据Cortellis数据库,截至目前全球在研的TCR-T项目中,70%以上适应症为实体瘤,主要包括转移性非小细胞肺癌、肝细胞癌、多发性骨髓瘤、软组织肉瘤、头颈癌、黑色素瘤、脂肪肉瘤和宫颈癌等。从靶点来看,癌-睾丸(CT)抗原依然是研发热点,靶向NY-ESO-1的项目数量位居前列。NY-ESO-1是最常见的靶向抗原,在多种癌症中均有表达,包括骨髓瘤、黑色素瘤等。其他肿瘤睾丸相关抗原,如PRAME和MAGE蛋白,以及黑色素瘤分化抗原MART-1和gp100,以及最近的癌症驱动因子,如WT1、KRAS和TP53,也是流行的TCR-T靶点。 美国国家癌症研究所肿瘤治疗领域的免疫泰斗带领团队,使用MART-1特异性TCR-T细胞治疗黑色素瘤,客观缓解率为12%(2/17),且患者病情缓解均超过20个月,另有部分患者在治疗2个月后外周血T细胞数量至少增加10%,这些数据证明了TCR-T细胞治疗在临床上的可行性应用。 该团队进一步证实了针对NY-ESO-1的特异性TCR-T细胞对黑色素瘤和滑膜肉瘤患者的临床疗效。于2015年正式发表了完整的临床试验结果,其中滑膜肉瘤组客观缓解率为61%(11/18),黑色素瘤组客观缓解率为55%(11/20),对正常组织无毒副作用性。 Steven Rosenberg团队表明,外显子组测序可用于识别被过继转移的肿瘤反应性T细胞识别的人类肿瘤新生抗原。 该团队治疗了一名患有ERBB2IP点突变的晚期难治性胆管癌患者,接受反应性的ERBB2IP特异性T细胞输入治疗后的患者肿瘤缓解,存活时间显着延长,在学术界引起了巨大轰动。此后,TCR-T细胞治疗的靶点向着个体化肿瘤新生抗原发展。 通过计算机更进一步模拟计算,整合多种相似性抗原的信息,也有团队试图研发在一定程度上同时识别多种抗原的多靶点反应性T细胞,增加T细胞的抗肿瘤作用。 荷兰研究人员分离的健康人群来源的T细胞,对黑色素瘤中表达的预测肿瘤新生抗原有免疫反应,这表明健康献血者的幼稚T细胞库也可作为特异性T细胞的来源。 一项针对HPV相关上皮癌的TCR-T细胞治疗的首次人体 I/II 期研究表明,HPV16 E6 TCR-T细胞可用于难治性、转移性HPV16阳性上皮癌患者,达到肿瘤消退和客观缓解。在安全性方面,特异性TCR-T治疗既没有出现靶向自身免疫毒性,也没有出现针对健康组织的脱靶交叉反应。 美国临床肿瘤学会 (ASCO)年会中公布的一项采用TCR-T疗法Afamitresgene Autoleucel(ADP-A2M4)治疗晚期/转移性滑膜肉瘤或粘液样脂肪肉瘤患者的2期临床试验SPEARHEAD-1结果显示,通过TCR-T疗法治疗高表达NY-ESO-1、检测配型为HLA-A2的滑膜肉瘤的效果显著,缓解率为 41.4%,总体疾病控制率为84.8%。 除此之外,在2021年纪念斯隆凯特琳癌症中心公布了另一项采用TCR-T疗法治疗滑膜肉瘤和非小细胞肺癌的临床试验。本次临床试验采用了高表达NY-ESO-1和/或LAGE-1a的晚期滑膜肉瘤和非小细胞肺癌,使用TCR-T疗法GSK3845097和GSK3901961进行治疗,虽然目前尚未有相关临床数据披露,但研究人员表示,该临床试验有望成为支撑TCR-T疗法治疗滑膜肉瘤的另一有力证据。 2022年欧洲肿瘤内科学会(ESMO)大会中公布了TCR-T疗法ADP-A2M4CD8治疗实体瘤的1期临床试验结果,数据显示,在所有的癌症类型的43名患者中,采用单剂ADP-A2M4CD8治疗的客观缓解率为33%,疾病控制率为81%。尤其是在晚期卵巢癌、尿路上皮癌、头颈癌中,ADP-A2M4CD8的总体客观缓解率达到44%,其中卵巢癌客观缓解率为36%(5/14),疾病控制率为 86%(12/14);尿路上皮癌客观缓解率为43%(3/7),疾病控制率为 86%(6/7);头颈癌客观缓解率为75%(3/4)。 2022年1月,美国食品和药物管理局(FDA)已批准全球首个T细胞受体(TCR)疗法Kimmtrak(IMCgp100)上市,用于治疗HLA-A*02:01阳性不可切除性或转移性葡萄膜黑色素瘤(mUM)成人患者,成为T细胞受体(TCR)疗法治疗实体瘤的重要里程碑。同年2月Adaptimmune已向FDA滚动提交了Afami-cel的BLA,预示着首款TCR-T细胞疗法即将步入商业化阶段。 《自然·医学》近期更新的临床试验数据显示,共有38名平均接受过3种全身治疗失败的极晚期患者接受了新型的TCR-T疗法,包括恶性程度极高的滑膜肉瘤,卵巢癌,头颈癌,胃癌,粘液样/圆形细胞脂肪肉瘤,非小细胞肺癌,尿路上皮癌,食道癌和黑色素瘤。结果显示针对所有癌症类型,总体确认的客观缓解率(ORR)为 24%(n = 9/38),疾病控制率(DCR)达到了74%,这意味着大部分晚期患者的病情在接受TCR-T治疗后得到了有效控制。 特别值得一提的是,在 16 名经过大量预处理的转移性 滑膜肉瘤患者中,客观缓解率(ORR)高达44%,这意味着近一半的患者肿瘤显著缩小30%以上甚至消失,疾病控制率(DCR)高达 94% 在开发TCR-T疗法的29家制药公司中,葛兰素史克和Adaptimunime发起了最多的临床试验,分别为11项和7项。最近,报道了一项针对人乳头瘤病毒(HPV)-16 E7蛋白的TCR-T细胞治疗转移性人乳头瘤病毒相关上皮癌的1期临床试验(NCT02858310)。 在这项研究中,12名接受治疗的患者中有6名出现了客观的临床反应,观察到了稳健的肿瘤消退。这是TCR-T细胞疗法的一个里程碑式的临床试验,证明靶向病毒抗原对病毒相关癌症患者具有良好的临床效果。其他被探索为TCR靶点的病毒抗原包括HPV-E6蛋白、来自EB病毒(EBV)的抗原和人类内源性逆转录病毒(HERV)靶点,如HERV-E。 自2023年以来,肿瘤新生抗原 TCR-T细胞治疗实体瘤,如黑色素瘤、转移性结直肠癌、胶质母细胞瘤、粘液细胞脂肪肉瘤、滑膜肉瘤、转移性HPV16相关宫颈癌、肛门癌、口咽癌和阴道癌,已取得部分喜人的结果。 特别是对肝癌、黑素瘤、滑膜细胞肉瘤的临床数据都显示出了强大的抗癌活性。国内外在这一领域均取得了不少突破性进展,不少临床阶段的企业公布了临床数据,并有多款产品正在向临床推进,相信这一疗法未来将在各类实体肿瘤广泛应用。 参考文献: 1.Engineered TCR-T CellImmunotherapy in Anticancer Precision Medicine: Pros and Cons. Front Immunol. 2021;12: 658753. 2.https://med.sina.com/rticle_detail_100_2_105979.html 3.https://baijiahao.baidu.com/sid=1706820055765951309&wfr=spider&for=pc